Третий этап испытания вакцины в чем заключается
Как обычно тестируется вакцина?
Есть три этапа испытаний. Только вакцина, прошедшая тестовую фазу, может перейти на следующий уровень испытаний. Если вакцина на каком-то этапе не соответствует требованиям, ее испытания прекращаются.
В фазе 1 испытаний проводится проверка безопасности вакцины.
Обычно вакциной-кандидатом вакцинируется порядка ста здоровых молодых людей, после чего описываются и анализируются ее побочные эффекты, чтобы определить, достаточно ли безопасна вакцина при введении людям. Эта фаза продолжается от нескольких недель до месяцев.
В фазе 2 испытаний определяется необходимая доза вакцины.
Несколько сотен людей из разных возрастных групп получают повышенные дозы вакцины, чтобы определить дозу, при которой они вырабатывают достаточное количество антител в крови. Также определяется, сколько раз требуется введение вакцины, и с каким интервалом, для выработки напряженного иммунитета. Продолжительность этого этапа составляет от нескольких месяцев до года.
И, наконец, в фазу 3 проводится тестирование эффективности вакцины. В этой фазе вакцинируется несколько тысяч человек из всех возрастных групп. Кроме того, контрольная группа получает плацебо. Исследователи проводят наблюдения чтобы выяснить, защищает ли вакцина от инфекции. Если заболеваемость в группе субъектов, вакцинированных вакциной-кандидатом значительно ниже, чем у испытуемых, вакцинированных плацебо, значит, вакцина-кандидат эффективна. Этот этап испытаний в среднем длится от одного года до полутора лет.
Исследования на группах добровольцев могут частично заменить трудоемкие и дорогостоящие исследования фазы 3.
В разных странах некоторыми исследователями и разработчиками вакцин периодически предлагается пропустить эксперименты на животных и немедленно протестировать вакцины-кандидаты на людях. Однако большинство фармацевтических компаний не склонно исключать какие-либо этапы исследований, чтобы сэкономить время. Профиль безопасности вакцины ставиться на первое место.
На сегодняшний день во всем мире университетами и фармацевтическим компаниями разрабатываются более 123 вакцин-кандидатов, причем новые вакцины появляются чуть не каждую неделю. Большинство вакцин находятся на стадии лабораторных экспериментов или экспериментов на животных. Малая часть проходит испытания на людях.
Все эти вакцины работают по одному и тому же принципу. Они подвергают организм воздействию одного или нескольких вирусных компонентов, которые сами по себе не вызывают заболевания, но позволяют нашей иммунной системе распознавать вирус и быстро и эффективно уничтожить его при попадании в организм.
При создании вакцины могут использоваться разные способы. Например, может использоваться убитый температурой или определенными химическими веществами вирус SARS-CoV-2. Преимущества таких вакцин заключается в том, что с технической точки зрения их довольно легко производить. Недостатком таких вакцин является то, что для их производства необходимо культивировать большое количество вируса, и полностью уничтожить каждую вирусную частицу. С помощью этой техники производятся вакцина против гепатита А, а также вакцина против гриппа.
Также для создания вакцины может использоваться генетически ослабленный, но живой вирус SARS-CoV-2. Генетический код вируса изменяют в лаборатории, так что он больше не вызывает заболевание, а создает иммунитет. Такие вакцины приводят к формированию устойчивого иммунитета, однако, хоть и очень редко, ослабленный вирус может снова превратиться в свой опасный вариант. С помощью этой техники созданы вакцины от эпидемического паротита, кори, краснухи, желтой лихорадки.
Также для создания вакцины можно использовать другой, безвредный вирус в качестве переносчика для встроенных в него генов SARS-CoV-2. В организме эти гены отвечают за синтез белков, которые вызывают иммунный ответ. Созданные таким образом вакцины довольно безопасны и вызывают достаточную иммунную защиту. Однако при наличии иммунитета к вирусу-переносчику эффективность вакцины может снизиться. С помощью этой техники создана вакцина против лихорадки Эбола.
Чаще всего при создании вакцины используются части белков микроорганизма, в нашем случае используются белки вируса SARS-CoV-2
Так можно производить вакцины безопасно, быстро и в достаточных количествах. Однако такие вакцины вызывают ограниченную иммунную защиту, также часто требуется ревакцинация. По этой методике производятся вакцина против коклюша и вакцина против рака шейки матки.
Врач рассказал о трех стадиях испытаний и разработки вакцины от COVID-19
Правильная вакцина является единственным решением пандемии, поэтому большинство лабораторий придерживаются существующих правил, предусматривающих обязательные три стадии клинического тестирования вакцины. Об этом в интервью «РИА Новости» заявил израильский иммунолог, профессор Яков Беркун.
По его словам, первая фаза проводится на небольшом количестве испытуемых с хорошим здоровьем. Она подразумевает первичные результаты по безопасности вакцины, чтобы не было серьезных побочных явлений.
Во время второй стадии используется группа из нескольких сотен испытуемых, где проверяют реактогенность препарата и выбирают правильную дозу. В третьей фазе примут участие десятки тысяч человек, она будет проходить в реальных условиях, при которых исследователи планируют выяснить, насколько эффективно работает препарат с учетом высокой заражаемости.
Ученый отметил, что серьезность пандемии и сохраняющиеся высокие темпы распространения вируса могут подтолкнуть ученых к сокращению стадий исследования. Профессор добавил, что исследователям приходится рисковать в поиске правильного решения и в поиске вакцин.
«Поэтому принятое в современной науке строгое соблюдение всех фаз, возможно, необязательно. Но тем не менее большинство западных фармакологических компаний и научных институтов все-таки проводят три фазы. Иногда проводятся параллельно, не ждут результатов предыдущей фазы и переходят к следующей», — заявил Беркун.
На данный момент разработкой вакцины в мире занимаются сотни лабораторий. Из них около 140 находятся на доклинический фазе и проверяют действие вакцины на животных, примерно 20 перешли к клинической фазе испытания на людях, и три или четыре исследовательские группы из Китая и США уже сообщили о переходе к третьей фазе клинических испытаний на больших количествах людей.
Иммунолог отметил сообщения Сеченовского университета, которые свидетельствуют о завершении первой фазы. Ранее директор Института трансляционной медицины и биотехнологий Сеченовского университета Вадим Тарасов заявил, что исследование вакцины от коронавируса на добровольцах успешно завершилось, первая группа добровольцев будет выписана уже в среду, вторая — 20 июля.
Также он прокомментировал результаты разработки первой стадии вакцины китайских ученых, у которых, как и у российских, не было побочных явлений. Кроме того, вторая фаза испытаний российской вакцины от коронавируса завершится до 28 июля в центре эпидемиологии микробиологии имени Гамалеи, после чего будет подана заявка на регистрацию. В Минобороны России заявили, что испытания проводятся без каких-либо попыток сокращения сроков исследования и в полном соответствии с методологией.
Израильский ученый также назвал примером прохождения стадий проверки вакцины по традиционной схеме американской компанию Moderna, где завершается вторая стадия испытаний. Израиль уже заключил с компанией соглашение о поставке вакцины.
13 июля директор центра Гамалеи Александр Гинцбург заявил, что разработанная вакцина может поступить в гражданский оборот в середине августа.
10 июля сообщалось, что специалисты Минобороны и ученые из Центра им. Н.Ф. Гамалеи приступили к завершающей стадии проведения клинических испытаний вакцины.
15 июля планируется выписка первой группы добровольцев, на которых проверялась безопасность вакцины, сообщили 10 июля в военном ведомстве. Состояние участников испытаний оценивается как хорошее, жалоб на самочувствие или на негативные реакции от препарата не поступало.
6 июля стало известно, что ВОЗ заинтересовалась российской вакциной от коронавируса.
Распространение коронавируса SARS-CoV-2, вызывающего заболевание COVID-19, началось в конце декабря прошлого года. Очагом инфекции стал китайский город Ухань.
Актуальная информация по ситуации с коронавирусом доступна на сайтах стопкоронавирус.рф и доступвсем.рф, а также по хештегу #МыВместе. Телефон горячей линии по вопросам коронавируса: 8 (800) 2000-112.
В Москве началась третья фаза клинического испытания вакцины от COVID-19 для подростков
11 ноября 2021 года о начале заключительной фазы клинического испытания подростковой вакцины сообщила заместитель мэра Москвы по вопросам социального развития Анастасия Ракова.
В этом исследовании изучается безопасность и эффективность вакцины «Спутник М» у людей в возрасте 12—17 лет. Новый препарат очень похож на вакцину «Спутник V», но в нем в пять раз меньше действующего вещества, чем в вакцине для взрослых.
Будьте внимательны к источникам информации о здоровье — и сходите к врачу
Наши статьи написаны с любовью к доказательной медицине. Мы ссылаемся на авторитетные источники и ходим за комментариями к докторам с хорошей репутацией. Но помните: ответственность за ваше здоровье лежит на вас и на лечащем враче. Мы не выписываем рецептов, мы даем рекомендации. Полагаться на нашу точку зрения или нет — решать вам.
Нужно ли прививать детей и подростков от COVID-19
Да, нужно. По данным из Великобритании, США, Италии, Австралии, Китая и Южной Кореи, на детей и подростков приходится до 16% всех подтвержденных случаев коронавирусной болезни.
При этом подростки 12—17 лет заражаются примерно вдвое чаще, чем дети в возрасте 5—11 лет. По некоторым данным, болеют они тоже тяжелее. Среди всех людей моложе 21 года, которые умерли от ковида в США с февраля по июль 2020 года, 70% пришлось на тех, кто был в возрасте 10—20 лет.
Оценив эти данные, специалисты из американского Центра по контролю и предотвращению заболеваний, или CDC, и представители Европейской технической консультативной группы экспертов по иммунизации, или ETAGE, пришли к выводу, что польза от вакцинации людей 12—15 лет превышает любые известные и потенциальные риски от этой процедуры.
Курс о больших делах
Что мы знаем об эффективности подростковых вакцин от коронавирусной болезни
На сегодняшний день для детей 5—11 лет и подростков 12—17 лет одобрен только один препарат — Comirnaty от Pfizer-BioNTech. Это вакцина на основе матричной РНК, или мРНК. Таких лекарств в нашей стране нет.
В клинических испытаниях эффективность двух доз Comirnaty у подростков составила 100%. В реальных условиях оценить ее эффективность пока сложно, но считается, что прививка помогает избежать госпитализации в 93% случаев.
Серьезные побочные эффекты от вакцинации возникают крайне редко. Хотя поступали сообщения о миокардите, то есть воспалении сердечной мышцы, и перикардите, то есть воспалении оболочки сердца, риск составляет примерно 54 случая на миллион введенных доз вакцины.
Тяжелые аллергические реакции на компоненты вакцины у подростков случаются очень редко, как и у взрослых людей.
Подростков старше 12 лет за рубежом прививают таким же препаратом, как и взрослых. Дети в возрасте 5—11 лет получают вакцину Comirnaty, в которой содержится треть действующего вещества.
Из всех вакцин, которые применяют в нашей стране, самые лучшие доказательства безопасности и эффективности есть у двух препаратов: «Спутник V» и «Спутник Лайт». Эти лекарства относятся к группе аденовирусных вакцин. Данными о безопасности и эффективности таких вакцин у подростков пока не располагает ни одно государство в мире.
Насколько опасно участвовать в третьем этапе клинических испытаний
Самым рискованным считается первый этап клинических испытаний, на котором проверяют безопасность дозировки и стремятся выявить как можно больше побочных эффектов препарата. Участников обычно немного: от 20 до 80 человек.
Иногда первый этап сразу совмещают со вторым, то есть проверяют не только безопасность, но и эффективность лекарства. Судя по доступным данным, «Спутник М» проверяли именно по такой схеме. Испытания подростковой вакцины проходили на базе Морозовской детской больницы и детской больницы им. З. А. Башляевой.
Там же было сказано, что дети перенесли прививку легче, чем взрослые участники первой и второй фазы клинического испытания «Спутника V».
Во время первого и второго этапа клинических испытаний взрослой версии лекарства участники чаще всего жаловались на боль в месте инъекции — 58%, повышение температуры — 50%, головную боль — 42%, слабость — 21%, и боль в мышцах и суставах — 24%. Серьезных побочных эффектов выявлено не было.
Если лекарственный препарат успешно проходит первую и вторую фазу клинических испытаний, начинается третья фаза. В ней участвуют больше всего добровольцев — от 1000 до 3000 участников. Планируется, что в третьей фазе испытаний «Спутника М» примут участие 3000 человек: 2400 получат вакцину, а 600 — плацебо.
Как принять участие в клиническом испытании
Участвовать в исследовании смогут только здоровые подростки, не болевшие COVID-19, у которых нет медицинских противопоказаний и аллергии на полиэтиленгликоль. В состав вакцины входит похожее на него вещество — полисорбат 80, на который тоже может случиться аллергия.
В клиническом испытании нельзя участвовать тем, что простужался за две недели до даты вакцинации или делал прививку от другой болезни в последние 30 дней.
Чтобы принять участие в исследовании, необходимо отправить заявку на почту vacdeti@zdrav.mos.ru.
несовершеннолетних в России — Ассоциация организаций по клиническим исследованиям
При этом без согласия родителей поучаствовать в клиническом исследовании не получится. Если добровольцу еще не исполнилось 14 лет, форму информированного согласия на участие в исследовании должны подписать его родители. А если уже исполнилось, то форму подписывают и родители, и сам подросток.
Как будет проходить клиническое испытание
Перед началом исследования добровольцы должны будут посетить врача, который осмотрит их и направит на ПЦР-тест — это нужно, чтобы убедиться, что потенциальный участник не болеет коронавирусной болезнью прямо сейчас, и на анализ крови на антитела к COVID-19 — это позволит понять, что доброволец не болел в прошлом.
Заодно у потенциальных участников исследования проверят общее состояние здоровья: возьмут кровь на биохимический и общий клинический анализ крови, ВИЧ, гепатит, общий анализ мочи, а также сделают электрокардиограмму.
Если исследования покажут, что доброволец может участвовать в исследовании, его пригласят повторно посетить исследовательский центр для первой прививки. Второй укол сделают через 21 день. И после первой, и после второй прививки нужно будет вести онлайн-дневник о своем самочувствии.
На 28-й день после первой прививки всем участникам снова сделают электрокардиограмму — это поможет убедиться, что прививка не повредила сердцу. Затем возьмут кровь на коагулограмму — это позволяет выяснить, насколько хорошо свертывается кровь, и снова сделают такие же анализы, как и в первый раз. А еще расскажут, в какую группу попали участники. Если это была группа плацебо, добровольцам сделают прививку настоящей вакциной.
В голове у многих родителей, к сожалению, творится тот же звездец. Ребенка детсадовского возраста запросто сажают на никем не исследованную веганскую диету, лишая нормального развития. Мажут нос звездочкой и оксолиновой мазью «от вирусов», пичкают кагоцелом и «сахарными шариками» из гомеопатической поликлиники, пугливо игнорируя прописанные врачом антибиотики. Доводя банальную детскую ангину до менингита и сепсиса. С таким подходом неудивительно, что любая вакцинация превращается в одну непрекращающуюся истерику в родительских чатах.
Началась третья фаза клинических исследований вакцины от Covid-19. Разбираемся, что это значит
— Что именно называют клиническими исследованиями? Это весь процесс разработки лекарства или какая-то его часть?
— Клинические исследования — это фаза, предшествующая регистрации и лицензированию лекарственного средства.
Сначала ведут поиск потенциальных молекул. Затем их эффективность и безопасность оценивают в лабораторных условиях на клеточных культурах или животных, что регулируется международными правилами. Если молекула показала положительные результаты на этапе доклинических исследований, препарат начинают оценивать в клинических исследованиях.
Клинические исследования до регистрации проходят три фазы. И в случае положительных результатов формируют досье для регистрации, которое подают в государственные органы.
Редко, но бывают ситуации, когда компания-разработчик считает результаты положительными, но государственные органы или наднациональные международные структуры — в России это Минздрав, в США — Food and Drug Administration (FDA), в Европейском союзе — European Medicines Agency (EMA) — признают данные недостаточными для регистрации лекарственного средства.
— Какой процент лекарств со стадии разработки доходит до пациента?
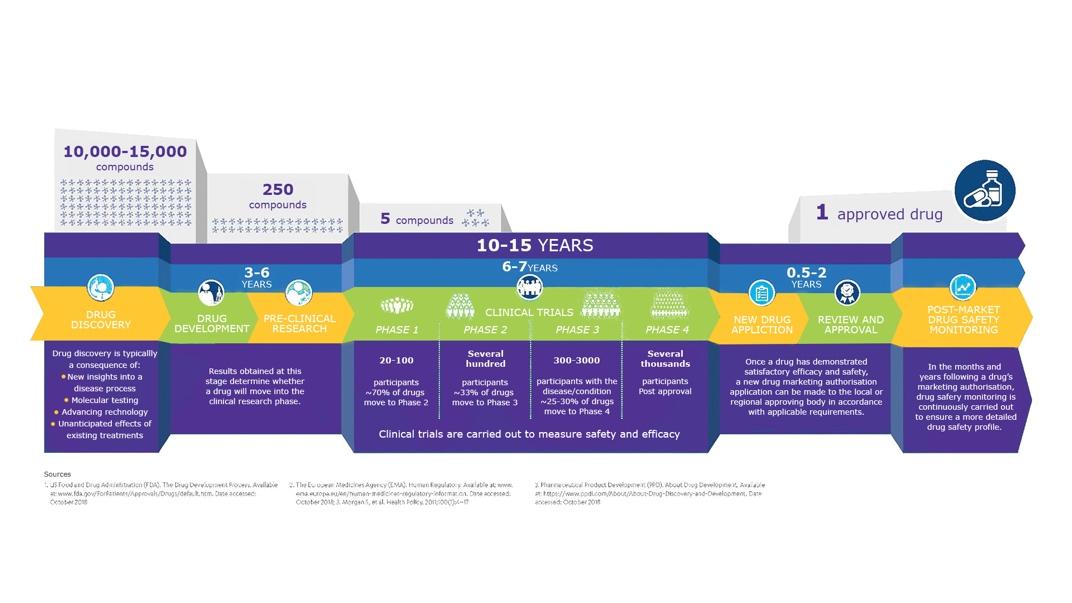
— Из 10–15 тысяч потенциальных молекул регистрируется всего одна. Поиск новых препаратов ведут, в первую очередь, исходя из нерешенных клинических вопросов. В последнее время при поиске и разработке новых лекарственных средств используют большие массивы данных и искусственный интеллект.
До стадии доклинических исследований из 10–15 тысяч молекул доходят в среднем 250. Доклинические исследования длятся 3–6 лет, и в среднем пять молекул из 250 выходят на клинические исследования.
Клинические исследования имеют четыре фазы. Первая фаза проходит на здоровых добровольцах. Ее цель — подтвердить безопасность препарата для человека, а также собрать данные по фармакокинетике. В среднем, она длится 1–2 года, в ней участвуют 20–80 пациентов.
Во второй фазе лекарственный препарат назначают уже пациентам с заболеванием, для лечения которого он разрабатывается. Вторая фаза занимает не менее 2–3 лет с участием 80–100 пациентов, и в ходе данной стадии оцениваются эффективность и безопасность, а также определяются минимальная эффективная доза и оптимальный режим дозирования.
В третьей фазе действие исследуемого препарата сравнивают со стандартным лечением. Она занимает 3–4 года и в ней участвуют 1000–4000 пациентов.
Четвертая фаза проводится после регистрации препарата и обычно ставит своей целью получение дополнительных данных как в контролируемых условиях, так и в условиях обычной клинической практики.
Из пяти лекарственных препаратов, дошедших до клинических исследований, регистрируется только один. Процесс регистрации занимает от 1,5 до 2 лет.
Таким образом, с момента поиска новой молекулы до его регистрации проходит 10–15 лет.
От трагических последствий — к единым правилам
— Как появились современные нормы проведения клинических исследований?
— В первую очередь, внимание уделялось этическим принципам проведения исследований. Правила формулировались в течение всего XX века — в основном, как результат трагических последствий отсутствия должного регулирования.
Первый такой пример — эликсир сульфаниламида, поступивший в продажу в 1937 году. Сам сульфаниламид — один из первых антибиотиков — успешно использовался и до этого, но производитель предложил новую удобную форму — сироп на основе диэтиленгликоля со вкусом малины. К сожалению, выбранный растворитель оказался чрезвычайно токсичным. Он вызывал острую печеночную и почечную недостаточность и привел к смерти первых же пациентов.
В результате уже в 1938 году конгресс США принял федеральный акт о пищевых продуктах, лекарственных средствах и косметике. Он предоставил государству контроль над разработкой лекарственных препаратов.
Следующим важным шагом стал Нюрнбергский кодекс 1947 года. Он стал ответом на бесчеловечные опыты на людях, которые проводились во время Второй мировой войны, и закрепил этические нормы обращения с пациентами в процессе клинических исследований.
В 1961 году была еще одна драматическая страница — вокруг уже испытанного лекарства — талидомида. Он обладал снотворным действием, и его начали прописывать беременным женщинам. Оказалось, что препарат был с тератогенным эффектом и приводил к врожденным уродствам.
Все эти печальные страницы истории привели к появлению в 1964 году Хельсинкской декларации Всемирной медицинской ассоциации (ВМА).
— Так как можно и как нельзя работать с испытуемым с точки зрения этических принципов?
— Основополагающим документом в вопросах этики медицинских экспериментов является Хельсинкская декларация. Она адресована врачам и призывает других лиц, вовлеченных в медицинские исследования с участием человека в качестве субъекта, следовать этим принципам. Последние изменения были внесены на 64-ой ассамблее ВМА в Форталезе в 2013 году.
Ниже приведены основные принципы Хельсинкской декларации :
Польза от лечения должна быть выше рисков
— С какой целью проводятся клинические исследования?
— Клинические исследования проводятся, чтобы понять причины заболевания и механизмы его развития, а также совершенствовать его профилактику и терапию.
Но долг врача всегда — это защита здоровья и жизни человека и не только. Врач с должной этической и научной подготовкой понимает, что в зоне его ответственности также неприкосновенность личности пациента, его право в любой момент отказаться от лечения, его частная жизнь и конфиденциальность персональных данных.
Поэтому цель исследования никогда не может быть важнее прав и интересов его участников.
Пациентов привлекают только тогда, когда это оправдано с точки зрения их здоровья: риск не может быть выше, чем ожидаемая польза от лечения.
Специальные страховки гарантируют компенсацию и лечение участникам клинических исследований.
— А как понять, успешно ли исследование?
— Исследование конструируется таким образом, чтобы можно было сравнить предлагаемую терапию с наилучшей имеющейся на данный момент терапией или с плацебо, если таковой нет.
Также важно отметить, что современные нормы обязывают производителей публиковать все результаты исследований — не только положительные, но и отрицательные или нейтральные.
Важно, что с этической точки зрения исследование не должно проводиться повторно, если получены убедительные результаты. Тем самым минимизируются риски для пациентов, удается избежать «избыточного» числа исследований.
— Как регулируется проведения исследования?
— Для этого сегодня существует стандарт, который называется «Качественная клиническая практика» (GCP — Good Clinical Practice). Это международный стандарт, который позволил гармонизировать правила разных стран, то есть сделать их универсальными.
Это был большой шаг вперед — странам стало не нужно отдельно набирать свои когорты пациентов, причем произошло это без ущерба для качества исследования. Правила GCP были утверждены в ЕС и США в 1997 году, а в России принципы GCP были введены в 2005 году в ГОСТ Р 5279-2005 «Надлежащая клиническая практика».
Эти стандарты регулируют не только планирование и проведение исследований с участием человека, но и документальное оформление и представление результатов исследований. Последнее очень важно, потому что именно на основе этих документов государственные органы принимают решение о регистрации лекарственного препарата.
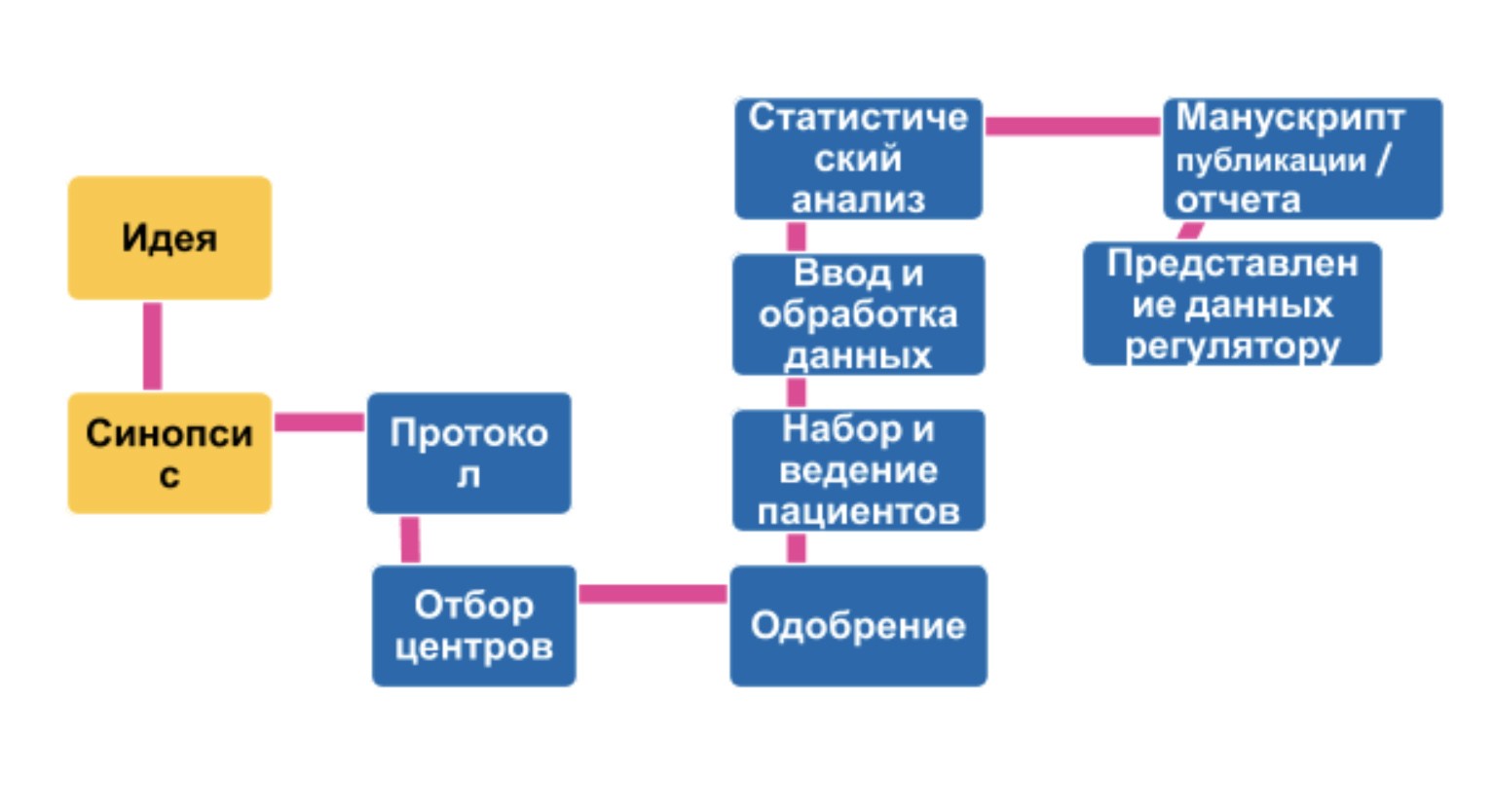
Синим помечены этапы, которые регулирует GCP стандарт
— Что гарантирует соблюдение стандарта «Качественная клиническая практика»?
— Соблюдение прав пациента и достоверность результатов исследований.
Это означает, что если после одобрения препарата в рамках обычной клинической практики доктора будут использовать его в соответствии с зарегистрированной инструкцией, то результаты будут сопоставимыми с результатами, полученными при клинических исследованиях.
— Как добиваются соблюдения этих правил?
— Любое клиническое исследование проходит две независимых экспертизы — научную и этическую.
Исследование рассматривает этическая комиссия. В ней должно быть не менее пяти человек, хотя бы один из них должен иметь квалификацию вне зоны медицины и еще один — не иметь отношения к организации, проводящей исследования.
Каждый пациент перед началом исследования подписывает форму информированного согласия, где подробно и понятно описаны цели исследования, права пациента, риски и ряд других стандартных пунктов. Важно, что пациент в любой момент может отозвать информированное согласие без объяснения причин. Тем самым подтверждается принцип добровольного участия любого пациента.

%204.jpg)