Триоксид водорода что это
Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Соединения водорода
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
2. Водород взаимодействует со сложными веществами:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
Ag + Н2O ≠
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
6. Бинарные соединения неметаллов также гидролизуются водой.
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
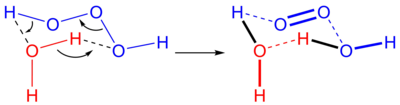
Триоксидан (также систематически называемый μ-триоксидандиидодигидроген), также называемый триоксид водорода или же дигидроген триоксид, является неорганическое соединение с химическая формула H [O]
3 ЧАС (также пишется как [H (μ-O
3 )ЧАС] или же [ЧАС
2 О
3 ] ). Это один из нестабильных полиоксиды водорода. [2] В водных растворах триоксидан разлагается с образованием воды и синглетный кислород:
Содержание
Подготовка
Реакция озона с перекисью водорода известна как «пероксоновый процесс». Эта смесь некоторое время использовалась для очистки грунтовых вод, загрязненных органическими соединениями. В результате реакции образуется H2О3 и H2О5. [6]
Структура
Реакции
Триоксидан легко разлагается на воду и синглетный кислород с периодом полураспада около 16 минут в органических растворителях при комнатной температуре, но только миллисекунды в воде. Он реагирует с органическими сульфидами с образованием сульфоксиды, но о его реакционной способности мало что известно.
Недавние исследования показали, что триоксидан является активным ингредиентом, отвечающим за противомикробный свойства хорошо известных озон/пероксид водорода смешивание. Поскольку эти два соединения также присутствуют в биологических системах, утверждается, что антитело в организме человека может генерировать триоксидан как мощный окислитель против вторжения бактерий. [3] [8] Источником соединения в биологических системах является реакция между синглетным кислородом и водой (которая протекает в любом направлении, конечно, в зависимости от концентрации), при этом синглетный кислород вырабатывается иммунными клетками. [4] [9]
Вычислительная химия предсказывает, что существует больше молекул кислорода или полиоксидов водорода, и что даже бесконечно длинные кислородные цепи могут существовать в низкотемпературном газе. При наличии этого спектроскопического доказательства поиск молекул такого типа может начаться в межзвездное пространство. [7]
Воздействие сварочного аэрозоля на организм электросварщика (ручная дуговая сварка). Рекомендации по измерению. И. А. Борскивер (№4, 2016)
Член Совета НАЦОТ, эксперт СДСОТ
В статье рассматривается воздействие на организм электросварщика при ручной дуговой сварке таких вредных факторов сварочного производства, как повышенная запыленность и загазованность воздуха рабочей зоны, а также даны рекомендации по измерению вредных веществ сварочного аэрозоля.
Ключевые слова: сварочный аэрозоль, ручная дуговая сварка, твердая и газовая составляющие сварочного аэрозоля, предельно допустимые концентрации вредных веществ в воздухе рабочей зоны.
Exposure to welding fumes on the body electric welder (manual arc welding). recommendations for measurement
Member of NATsOT Board (National Association of Occupational Safety and Health Centers), SDSOT expert (Voluntary Certification Organizations, Professionals System)
It is shown the effect on the electric welder for manual arc welding of such hazards of welding production as increased dust and fumes in the air of the working area, as well as recommendations for the measurement of pollutants welding fumes.
Keywords: welding spray manual arc welding, solid and gaseous components of welding fumes, the maximum permissible concentra-tions of harmful substances in the air of the working area
Высокая температура сварочной дуги способствует интенсивному окислению и испарению металла, флюса, защитного газа, легирующих элементов. Окисляясь кислородом воздуха, эти пары образуют мелкодисперсную пыль, а возникающие при сварке и тепловой резке конвективные потоки уносят газы и пыль вверх, приводя к большой запыленности и загазованности производственных помещений.
Мелкодисперсная пыль или же твердая составляющая сварочного аэрозоля (ТССА) состоит из мельчайших частиц перенасыщенных паров металлов и других веществ, входящих в состав сварочных, присадочных, напыляемых материалов и основного металла, которые конденсируются за пределами зоны высокотемпературного нагрева.
Скорость витания частиц ГССА — не более 0,08 м/с, оседает она незначительно, поэтому распределение ее по высоте помещения в большинстве случаев равномерно, что чрезвычайно затрудняет борьбу с ней.
Основными компонентами пыли при сварке и резке сталей являются окислы железа, марганца и кремния (около 41, 18 и 6% соответственно). В пыли могут содержаться другие соединения легирующих элементов. Токсичные включения, входящие в состав сварочного аэрозоля, и вредные газы при их попадании в организм человека через дыхательные пути могут оказывать на него неблагоприятное воздействие и вызывать ряд профзаболеваний. Мелкие частицы пыли от 0,4 до 5 мкм (микрометр 1/1000 часть миллиметра), проникающие глубоко в дыхательные пути, представляют наибольшую опасность для здоровья, пылинки размером до 10 мкм и более задерживаются в бронхах, также вызывая их заболевания.
К наиболее вредным пылевым выделениям относятся окислы марганца.
Марганец забивает канальцы нервных клеток. Снижается проводимость нервного импульса, как следствие повышается утомляемость, сонливость, снижается быстрота реакции, работоспособность, появляются головокружение, депрессивные, подавленные состояния.
Марганец почти невозможно вывести из организма; очень тяжело диагностировать отравление марганцем, т.к. симптомы очень общие и присущи многим заболеваниям, чаще же всего человек просто не обращает на них внимания.
Двуокись кремния при длительном вдыхании может вызвать профессиональное заболевание легких — Силикоз (silicosis, от лат. silex кремень)— это болезнь, при которой в легких образуется инородная ткань, которая снижает способность легких перерабатывать кислород, наиболее распространенное и тяжело протекающий вид пневмокониоза. Характеризуется диффузным разрастанием в легких соединительной ткани и образованием характерных узелков. Силикоз вызывает риск заболеваний туберкулезом, бронхитом и эмфиземой легких.
Соединения хрома способны накапливаться в организме, вызывая головные боли, заболевания пищеварительных органов, малокровие.
Окись титана вызывает заболевания легких.
Кроме того, на организм неблагоприятно воздействуют соединения алюминия, вольфрама, железа, ванадия, цинка, меди, никеля и других элементов.
Биологические свойства электросварочной пыли анализируются в три основных гигиенических показателя вредности пыли: растворимость, задержка при дыхании легочной тканью и фагоцитоз.
Газовая составляющая сварочного аэрозоля (ГССА) представляет собой смесь газов, образующихся при термической диссоциации (распад молекул на несколько более простых частиц) газошлакообразующих компонентов этих материалов (СО, СО2, HF и др.) или же за счет фотохимического действия ультрафиолетового излучения дугового разряда (плазмы) на молекулы газов воздуха (NO, NO2, О3).
Газы ГССА способны адсорбироваться на поверхности твердых частиц, захватываться внутрь их скоплений. При этом локальные концентрации газов, адсорбированных на частицах ТССА, могут существенно превышать их концентрации непосредственно в ГССА
Вредные газообразные вещества, попадая в организм через дыхательные пути и пищеварительный тракт, вызывают иногда тяжелые поражения всего организма.
К наиболее вредным газам, выделяющимся при сварке и резке, относятся окислы азота (особенно азота диоксид).
Азота диоксид воздействует в основном на дыхательные пути и легкие, он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких, а также вызывает изменения состава крови, в частности, уменьшает содержание в крови гемоглобина.
Углерод оксид (угарный газ) — бесцветный газ, имеет кисловатый вкус и запах; будучи тяжелее воздуха в 1,5 раза, уходит вниз из зоны дыхания, однако, накапливаясь в помещении, вытесняет кислород и при концентрации свыше 1 % приводит к раздражению дыхательных путей, вызывает сильную головную боль, слабость, головокружение, туман перед глазами, тошноту и рвоту, мышечная слабость потерю сознания.
Озон — газ, токсичный при вдыхании. Он раздражает слизистую оболочку глаз и дыхательных путей. Патологоанатомические исследования показали характерную картину отравления озоном: кровь не свертывается, легкие пронизаны множеством сливных кровоизлияний.
Фтористый водород (гидрофторид) обладает резким запахом, дымит на воздухе (вследствие образования с парами воды мелких капелек раствора) и сильно разъедает стенки дыхательных путей.
Вещество оказывает разъедающее действие на глаза, кожу и дыхательные пути. Вдыхание этого газа может вызвать отек легких. Вещество может оказывать действие на повышенный уровень кальция в крови, вызывая гипокальцемию, приводя к сердечной и почечной недостаточности.
Содержание вредных веществ сварочного аэрозоля в воздухе рабочей зоны на рабочих местах не должны превышать ПДК, указанным в ГН 2.2.5.1313-03 «Предельно допустимые концентрации(ПДК) вредных веществ в воздухе рабочей зоны», а наиболее вероятные вредные вещества, которые входят в состав сварочного аэрозоля в виде твердой (ТССА) и газовой (ГССА) составляющей сварочного аэрозоля приведены в МУ 4945-88 «Методические указания по определению вредных веществ в сварочном аэрозоле (твердая фаза и газы)»
Количество и состав сварочных аэрозолей зависят от вида сварки, химического состава сварочных материалов и свариваемых металлов, защитных покрытий, режимов сварки, состава защитных газов и газовых смесей.
Таблица 1. ПДК вредных веществ сварочного аэрозоля в воздухе рабочей зоны
ПДК в воздухе рабочей зоны * (м.р./с.с), мг/м 3
Преимущественное агрегатное состояние
Особенности действия на организм ****
Твердая составляющая сварочного аэрозоля (ТССА)
Алюминий, его сплавы, алюминия оксид (в том числе с примесью диоксида кремния) в виде аэрозоля конденсации
Борная кислота BH3O3
Бора оксид (диБор триоксид)
Ванадия (V) оксид (дым)
(диВанадий пентоксид, дым)
(диВанадий триоксид, пыль)
Железа оксид (диЖелезо триоксид)
Кадмий и его неорганические соединения
Кальция оксид (Кальций оксид +)
Кобальт металлический, кобальта оксид (Кобальт и его неорганические соединения +)
Кремния диоксид аморфный в смеси с оксидами марганца в виде аэрозоля конденсации с содержанием каждого из них более 10 %
Магния оксид (Магний оксид)
Марганец при его содержании в сварочном аэрозоле
Медь металлическая (Медь)
Молибден металлический (Молибден)
Никель металлический, его оксиды (в пересчете на никель) (Никель, никель оксиды, сульфиды и смеси соединений никеля (файнштеин,никелевый концентрат и агломерат,оборотная пыль очистных устройств) (по никелю)
Свинец и его неорганические соединения
Титан, титана диоксид
Фтористоводородной кислоты соли
а) хорошо растворимые
б) плохо растворимые
(диХром триоксид (по хрому (III))
Хрома (VI) оксид (Хром (IV) триоксид +)
Цинка оксид (Цинк оксид)
Цирконий металлический Циркония диоксид
Газовая составляющая сварочного аэрозоля (ГССА)
Фтористый водород (гидрофторид (в пересчете на фтор)
*в числителе – максимально разовая, в знаменателе – среднесменная ПДК, прочерк в числителе означает, что Норматив установлен в виде средней сменной ПДК. Если приведен один Норматив, то это означает, что он установлен как максимальная разовая ПДК.
В практике наиболее часто встречается сварка углеродистых и низколегированных конструкционных сталей общего назначения, для этого применяют электроды с различными видами покрытий:
рутиловыми, основу покрытия таких электродов составляют рутиловый концентрат (природный диоксид титана), к ним можно отнести такие марки электродов, как АНО-1, АНО-4, АНО-18, ОЗС-4, ОЗС-6, ОЗС-12, МР-3, РБК-5 и др.;
ильменитовыми, название это покрытие получило от минерала ильменита (FeO-Ti02), к ним можно отнести такие марки электродов как АНО-6, АНО-17, ОЗС-21, ОЗС 23 и др.;
кислыми, основу этого вида покрытия составляют оксиды железа, марганца и кремния, к ним можно отнести такие марки электродов как ОММ-5, СМ-5, ЦМ-7, МЭЗ-4 и др.;
целлюлозными, создается на основе органических соединений (до 50%) – целлюлозы, муки, крахмала, обеспечивающих газовую защиту. Для шлаковой защиты в небольшом количестве применяются рутиловый концентрат, мрамор, карбонаты, алюмосиликаты и другие. К ним можно отнести такие марки электродов, как ОЗС-3, ОЗС-4, ОЗС-12, ОЗС-21, ВЦС-4 и др.;
основными (фтористо-кальцевыми), шлаковую основу составляют минералы — в основном карбонаты кальция и магния (мрамор, магнезит, доломит), а также плавиковый шпат (CaF2). Поэтому они получили название фтористо-кальциевых покрытий. К ним можно отнести такие марки электродов как УОНИ-13, УОНИ-13/45, УОНИ-13/55, УОНИ-65 АНО-9, АНО-10.
При выполнении сварочных работ с применением электродов с перечисленными видами покрытий, в сварочном аэрозоле выделяются такие вредные вещества, как: марганец, диЖелезо триоксид, двуокись кремния, титана диоксид, углерод оксид, азота диоксид, озон, фтористый водород.
Для сварки легированных, высоколегированных, перлитных, атмосферокоррозионностойких и др. сталей, чугуна, бронзы, меди, латуни, никеля, применяются другие марки электродов, при этом выделяются элементы и соединения перечисленные в таблице 1. Подробней об этом приведено в приложении 6 МУ 4945-88.
Измерение вредных веществ сварочного аэрозоля производят в целях проведения специальной оценки условий труда, производственного или санитарного контроля. Измерения производят испытательные (измерительные) лаборатории, аккредитованные в установленном порядке, причем, измеряемые вредные вещества должны быть внесены в область аккредитации лаборатории.
Все основные нормативы, в т.ч. и ПДК рассчитаны на 8-ми часовую продолжительность рабочей смены.
Для ПДК некоторых веществ установлены две нормативные величины: максимально разовая и среднесменная предельно допустимые концентрации. Величина последней более точно отражает состояние воздушной среды на рабочем месте.
Определение среднесменной концентрации вредного вещества предполагает, что в условиях воздействия данного вещества с установленной концентрацией его содержания в воздухе рабочей зоны работник находится 100% времени рабочей смены, при этом учитывается и время воздействия на организм сварочного аэрозоля (время пребывания).
При определении среднесменной концентрации вредных веществ сварочного аэрозоля расчетным методом часто вызывает затруднение в определении времени выполнения сварочных работ (длительности этапа производственного процесса). Это обусловлено тем, что сварочные работы на многих предприятиях не носят стабильный характер, а операции не повторяются в течение рабочей смены ежедневно. В качестве примера к таким работам можно отнести электросварщиков в ремонтных подразделениях предприятии, бригадах трудоемких процессов сельхозпредприятий, в строительстве и т. п.
Время пребывания устанавливается приблизительно, приходится беседовать с сварщиком, бригадиром, мастером. При этом многие считают
Это ошибочное мнение, поскольку в данном случае не учитывается время на выполнение подготовительных, вспомогательных, текущих ремонтных работ, а также работ вне своего рабочего места в целях обеспечения выполнения своих трудовых функций.
Вспомогательные и работы по обслуживанию рабочего места – это текущий ремонт и обслуживание оборудования и приспособлений, поддержание рабочего места в санитарно гигиеническом, противопожарном и травмобезопасном состоянии, уход за инструментом и др. Такие работы могут составлять до 10% от рабочего времени.
Как определить время пребывания (время воздействия сварочного аэрозоля на организм сварщика)?
Есть мнение, что опытный сварщик расходует в час один килограмм электродов. В этом случае можно разделить общее количество электродов в килограммах на количество рабочих дней. Но данное мнение, на взгляд автора, не подходит для проведения измерений и оформления протоколов, поскольку расход электродов может зависеть от видов и способов сварки, диаметра и марки электродов, толщины свариваемых материалов, видов сварных соединений и швов и т.д.
Можно рассчитать расход электродов и время горения сварочной дуги расчетным способом. Для этого необходимо взять для расчетов наиболее часто применяемые электроды, свариваемые материалы, способы и режимы сварки:
где αн — коэффициент наплавки; Gн — масса наплавленного за время t металла, г (с учетом потерь).
Коэффициент наплавки зависит от рода и полярности тока, типа покрытия и состава проволоки, а также от пространственного положения, в котором выполняют сварку.
Коэффициент наплавки является одним из показателей характеристик электродов. Для электродов марки АОН-4, АНО-6, УОНИ-13 αн = 9-11 г/Ач Возьмем среднее значение 10
Основное время, to – время горения дуги можно вычислить по формуле:
to = Flγ/ Iαн, ч., где
F – площадь поперечного сечения наплавленного метала в см 2 ;
I – сварочный ток в а;
αн – коэффициент наплавки в г/а . ч
Площадь поперечного сечения, F, которая существенно зависит от сварного соединения, определяется геометрическим расчетом по ГОСТу 2564-80, как сумма площадей треугольников.
Длину шва, l для приведения к единице веса электродов необходимо вычислить из расчета расхода одного килограмма электродов.
На 1 кг. электродов: 1: 0,65 = 1.54 м. = 154 см. шва
Произведем расчет: to = 0,55*154*7,85: (176*10) = 0,378 час
Так как, длину шва приняли из расчета на 1 килограмм электродов, получается, что за 0,378 часа, в среднем, электросварщик расходует 1 кг электродов,
или за 1 час – 2,6 килограмм.
Время воздействия сварочного аэрозоля на организм сварщика в течение рабочего дня теперь можно вычислить по формуле:
Где: Pэл – количество электродов израсходованных электросварщиком в месяц
N – количество дней работы сварщика в течении месяца
1. МУ 4945–88 «Методические указания по определению вредных веществ в сварочном аэрозоле (твёрдая фаза и газы)».
2. ГОСТ 5264–80 (1993) Ручная дуговая сварка. Основные типы, конструктивные элементы и размеры.
3. Винокуров В. С. Оборудование и технология дуговой, автоматической и механизированной сварки. М.: Высшая школа, 2001.
4. Бабенко Э. Г., Казанова Н. П. Расчет режимов электрической сварки и наплавки: Методическое пособие. Хабаровск, 1999.
5. Фоминых В. П., Яковлев А. П. Ручная дуговая сварка. 7-е изд., испр. и доп. М.: Высшая школа, 1986.