впс авк полная форма у плода
Впс авк полная форма у плода
АВК может сочетаться с другими врожденными пороками сердца (открытым артериальным протоком, аномалиями полых вен) и пороками развития других органов (селезенки, печени) либо с тяжелыми генетическими заболеваниями (синдром Дауна – врожденное заболевание, вызванное мутацией хромосом (переносчиков генетической информации), проявляющееся в характерных внешних признаках и снижении интеллекта).
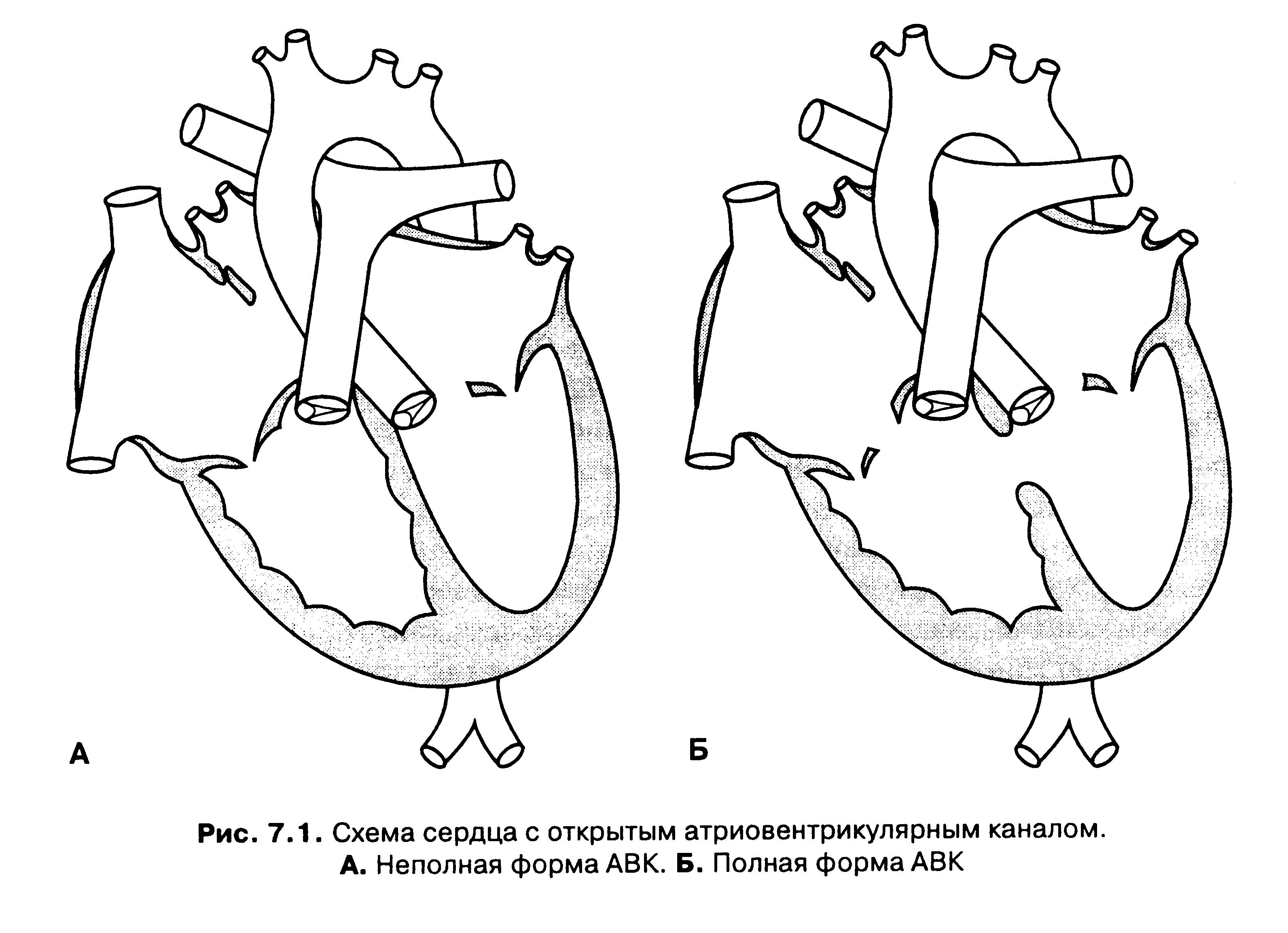
Полная форма АВК (рисунок Б) имеет несколько составляющих: дефект межпредесердной перегородки и дефект межжелудочковой перегородки, сливающиеся в одно огромное отверстие, и одно общее для обоих желудочков клапанное кольцо, регулирующееся двумя большими общими створками. Все отделы сердца работают с огромной перегрузкой, постоянно увеличенным объемом крови. Особенно оказывается переполненным малый круг. Давление в нем, естественно, повышается и, как и при больших ДМЖП, опасность быстрого развития необратимых изменений легочных сосудов очень высока.
Клинически порок протекает тяжело. Симптомы сердечной недостаточности появляются уже в первые месяцы жизни, и состояние ребенка требует постоянной лекарственной поддержки. Сердце быстро увеличивается в размерах — все его четыре камеры перегружены и с трудом справляются с работой. Ребенок очень болен, плохо ест и развивается, постоянно «подхватывает» простудные заболевания, часто заканчивающиеся воспалением легких. Состояние не критическое, но очень опасное. Операция необходима вскоре после точного установления диагноза. В нашей клинике радикальную коррекцию данного порока проводят в возрасте 3-6 мес.
В некоторых случаях оперативное лечение необходимо разбить на два этапа, т.е. вначале сузить легочную артерию (как при ДМЖП), а через несколько месяцев сделать радикальную операцию.
Неполная форма АВК (рисунок А) характеризуется отсутствием дефекта межжелудочковой перегородки, протекает более благоприятно. Оперативное лечение проводится обычно в возрасте старше 1 года.
Если вашему ребенку поставили диагноз врожденный порок сердца, не стоит опускать руки, нужно узнать все способы поддержания здоровья таких детей, а также причины развития данного заболевания, пройти необходимое обследование, чтобы врач назначил соответствующее лечение.
Сердце человека состоит из четырех камер: правое предсердие (ПП) и правый желудочек (ПЖ), левое предсердие (ЛП) и левый желудочек (ЛЖ). Правые и левые отделы сердца между собой никак не сообщаются. В этом нет необходимости, так как они обеспечивают движение крови каждый по своему кругу. Левые отделы сердца отвечают за движение крови по большому кругу кровообращения. Из левого предсердия через левый желудочек в аорту (Ао) поступает артериальная кровь, богатая кислородом. Из аорты по многочисленным артериям, а потом и по капиллярам она разносится по всему организму, доставляя клеткам кислород. В свою очередь, «отработанная» организмом венозная кровь собирается в мелкие вены, которые сливаются в более крупные венозные сосуды – верхнюю и нижнюю полые вены (ВПВ и НПВ). Конечная точка путешествия венозной крови – правое предсердие. Оттуда через правый желудочек кровь попадает в легочную артерию (ЛА). Малый круг кровообращения проходит через легкие, где венозная кровь обогащается кислородом и вновь становится артериальной. Отток обновленной крови осуществляется по легочным венам (ЛВ), впадающим, в свою очередь, в левое предсердие.
Особенности кровообращения у плода и новорожденного
Находясь в утробе матери, плод не дышит самостоятельно и его легкие не функционируют. Кровообращение осуществляется через плаценту. Насыщенная кислородом кровь матери поступает к плоду через пуповину: в венозный проток, откуда через систему сосудов в правое предсердие. У плода между правым и левым предсердием имеется отверстие – овальное окно. Через него кровь попадает в левое предсердие, затем в левый желудочек, аорту – и ко всем органам плода. Малый круг кровообращения отключен. В легкие плода кровь поступает через артериальный проток – соединение между аортой и легочной артерией. Венозный проток, овальное окно и артериальный проток имеются только у плода. Они называются «фетальными сообщениями». Когда ребенок рождается и пуповину перевязывают, схема кровообращения радикально изменяется. С первым вдохом ребенка его легкие расправляются, давление в сосудах легких снижается, кровь притекает в легкие. Малый круг кровообращения начинает функционировать. Фетальные сообщения больше не нужны ребенку и постепенно закрываются (венозный проток – в течение первого месяца, артериальный проток и овальное окно – через два-три месяца). В некоторых случаях своевременного закрытия не происходит, тогда у ребенка диагностируют врожденный порок сердца (ВПС). Иногда при развитии плода возникает аномалия и ребенок рождается с анатомически измененными структурами сердца, что также считается врожденным пороком сердца. Из 1000 детей с врожденными пороками рождается 8-10, и эта цифра увеличивается в последние годы (развитие и совершенствование диагностики позволяет врачам чаще и точнее распознавать пороки сердца, в том числе, когда ребенок еще в утробе матери).
«Синие» и «бледные» пороки сердца
Аномалии могут быть очень разнообразными, наиболее часто встречающиеся имеют названия и объединяются в группы. Например, пороки разделяют на «синие» (при которых кожные покровы ребенка синюшные, «цианотичные») и «бледные» (кожные покровы бледные). Для жизни и развития ребенка более опасны «синие» пороки, при которых насыщение крови кислородом очень низкое. К «синим» порокам относятся Тетрада Фалло, транспозиция магистральных сосудов, атрезия легочной артерии. К «бледным» порокам относятся дефекты перегородок – межпредсердной, межжелудочковой. В некоторых случаях порок может частично компенсироваться за счет открытого артериального протока (в норме он закрывается, как только легкие ребенка расправляются с первым криком). Также у ребенка может недоразвиться клапан сердца – сформируется клапанный порок (наиболее часто, аортальный клапан или клапан легочной артерии).
Причины развития врожденного порока сердца
У плода формирование структур сердца происходит в первом триместре, на 2-8 неделе беременности. В этот период развиваются пороки, которые являются следствием наследственных генетических причин или воздействия неблагоприятных внешних факторов (например, инфекция или отравления). Иногда у ребенка имеется несколько пороков развития, в том числе и порок сердца. Риск рождения ребенка с врожденным пороком сердца очень высок, если:
— ранее у женщины были выкидыши или мертворожденные
— возраст женщины более 35 лет
— женщина во время беременности принимает алкоголь, психоактивные вещества (наркотики), курит
— в семье женщины есть история рождения детей с пороками или мертворождения
— женщина живет в экологически неблагоприятной местности (радиация, отравляющие вещества)
или работает на экологически неблагоприятном производстве
— во время беременности (особенно первые 2 месяца) женщина перенесла инфекционные, вирусные заболевания
— женщина принимала во время беременности лекарственные препараты
с тератогенным эффектом (приводящие к развитию уродств у плода) или
эндокринные препараты для сохранения беременности (гормоны).
Можно ли поставить диагноз ВПС у плода?
Врожденный порок сердца у новорожденных
При рождении ребенка или в первые дни его жизни врачи могут заподозрить врожденный порок сердца.
На чем они основывают свои предположения?
— Шум в сердце. В первые несколько дней жизни ребенка шум в сердце нельзя расценивать как достоверный симптом врожденного порока сердца. Такого ребенка наблюдают, при сохранении шумов более 4-5 суток – обследуют. Само появление сердечного шума объясняется нарушением тока крови через сосуды и полости сердца (например, при наличии аномальных сужений, отверстий, резкой смены направления кровотока).
— синюшность кожных покровов (цианоз). В норме артериальная кровь богата кислородом и придает коже розовую окраску. Когда к артериальной крови примешивается бедная кислородом венозная кровь (в норме не происходит), кожа приобретает синюшный оттенок. В зависимости от типа порока цианоз может быть разной степени выраженности. Однако, врачам приходится уточнять причины цианоза, так как он может быть симптомом болезней органов дыхания и центральной нервной системы.
— проявления сердечной недостаточности. Сердце перекачивает кровь, работая как насос. Когда снижается насосная способность сердца, кровь начинает застаиваться в венозном русле, питание органов артериальной кровью снижается. Учащаются сердечные сокращения и дыхание, появляется увеличение печени и отечность, быстрая утомляемость и одышка. К сожалению, эти признаки очень трудно распознать у новорожденных. Высокая частота сердечных сокращений и дыхания наблюдается у маленьких детей в нормальном состоянии. Только при значительных отклонениях можно с достаточной уверенностью говорить о развитии у малыша сердечной недостаточности. Часто следствием развития сердечной недостаточности является спазм периферических сосудов, что проявляется похолоданием конечностей и кончика носа, их побледнением. Эти признаки помогают косвенно судить о недостаточности сердца.
— нарушения электрической функции сердца (сердечного ритма и проводимости), проявляющиеся аритмиями и, иногда, потерей сознания. Врач может услышать неровное сердцебиение при аускультации (выслушивании фонендоскопом) или увидеть на записи электрокардиограммы.
Как сами родители могут заподозрить у ребенка врожденный порок сердца?
Подтверждение диагноза врожденного порока сердца
В настоящее время наиболее доступным, простым, безболезненным для ребенка и высокоинформативным методом диагностики пороков сердца является эхокардиография. Во время исследования с помощью ультразвукового датчика врач видит толщину стенок, размеры камер сердца, состояние клапанной системы и расположение крупных сосудов. Допплеровский датчик позволяет увидеть направления кровотока и измерить его скорость. Во время исследования можно выполнить снимки, подтверждающие заключение специалиста. Также ребенку обязательно запишут электрокардиограмму. При необходимости более точного исследования (как правило, для определения тактики хирургического лечения порока) врач порекомендует зондирование сердца. Это инвазивная методика, для выполнения которой ребенок госпитализируется в стационар. Зондирование проводится врачем-рентгенхирургом в рентгеноперационной, в присутствии врача-анестезиолога, под внутривенным наркозом. Через прокол в вене или артерии специальные катетеры вводятся в сердце и магистральные сосуды, позволяя точно измерить давление в полостях сердца, аорте, легочной артерии. Введение специального рентген-контрастного препарата позволяет получить точное изображение внутреннего строения сердца и крупных сосудов (см. рисунок).
Диагноз – не приговор. Лечение ВПС (врожденного порока сердца)
Современная медицина позволяет не только своевременно диагностировать, но и лечить врожденные пороки сердца. Лечением ВПС занимаются кардиохирурги. При выявлении порока, сопровождающегося серьезным нарушением гемодинамики, влияющего на развитие ребенка и угрожающего жизни малыша, операция проводиться как можно раньше, иногда в первые дни жизни ребенка. При пороках, которые не влияют значительно на рост и развитие ребенка, операция может проводиться позже. Выбор сроков операции определяется хирургом. Если ребенку рекомендовали хирургическое вмешательство и его не удалось выполнить своевременно (часто из-за отказа родителей, непонимания серьезности проблемы), у ребенка может начаться патологическое изменение гемодинамики, приводящее к развитию и прогрессированию сердечной недостаточности. На определенном этапе изменения становятся необратимыми, операция уже не поможет. Отнеситесь внимательно к советам и рекомендациям врачей, не лишайте своего ребенка возможности расти и развиваться, не быть инвалидом на всю жизнь!
Операция при врожденных пороках сердца
Многие годы операции при врожденных пороках сердца выполнялись только на открытом сердце, с использованием аппарата искусственного кровообращения (АИК), который берет на себя функции сердца во время его остановки. Сегодня при некоторых пороках такой операции существует альтернатива – устранение дефекта структур сердца с помощью системы AMPLATZER. Такие операции значительно безопаснее, не требуют раскрытия грудной клетки, не отличаясь по эффективности от «большой» хирургии. Если операция выполнена своевременно и успешно, ребенок полноценно развивается и растет, и часто – навсегда забывает о существовании порока. После операции обязательным является наблюдение педиатра, контрольные эхокардиографические исследования. Дети с врожденными пороками сердца часто болеют простудными заболеваниями из-за снижения иммунитета, поэтому в послеоперационном периоде проводится общеукрепляющее лечение и ограничиваются физические нагрузки. В дальнейшем у многих детей эти ограничения снимают и даже разрешают посещать спортивные секции.
Статья была опубликована сотрудниками нашего Центра ранее на «Сибирском медицинском портале».
Открытый общий атрио-вентрикулярный канал
Если створки прирастают к межжелудочковой перегородке, то под ними межжелудочкового дефекта не будет. Остается только межпредсердное сообщение. Тогда говорят о «неполной форме», или первичном дефекте межпредсердной перегородки. Представить себе это очень просто — нарисуйте крест, а потом сотрите участок соединения вертикальной и горизонтальной линий. Вертикальная линия — межпредсердная (вверху) и межжелудочковая (внизу) перегородки, горизонтальная — клапаны, а пунктир — общие их створки: Это полная форма. А теперь соедините две горизонтальные линии с нижней вертикалью — получится буква «Y» с только одним отверстием сверху — это неполная форма порока.
В отличие от дефектов межжелудочковой перегородки, самостоятельно закрытие АВК не произойдет никогда.
Поговорим вначале о неполной форме порока. Его называют первичным дефектом межпредсердной перегородки потому, что это только большой дефект в ее нижней части. Но к нему присоединяется еще одно внутрисердечное нарушение — «расщепление» передней створки митрального клапана, две половины которой не срастаются между собой (и между ними образуется щель). Возникает недостаточность митрального клапана, т.е. при каждом сокращении через это расщепление часть крови из левого желудочка забрасывается обратно в левое предсердие. То есть, помимо дефекта межпредсердной перегородки, появляется еще одна причина, увеличивающая остаточный объем крови в полостях сердца и нагрузку на все его отделы.
Жалобы и клиническая симптоматика очень похожи на те, которые описаны для изолированных дефектов межпредсердной перегородки, но развиваются они раньше и с большей скоростью. Обычно в возрасте первых 3-6 месяцев жизни уже есть прямые показания к хирургической операции. Некоторые больные попадают к хирургам уже вполне взрослыми, но вероятность того, что они будут страдать нарушениями ритма даже после полного устранения дефекта, достаточно высока.
Суть операции заключается в закрытии дефекта с помощью заплаты (как правило, из собственного перикарда, т.е. плотной сумки, окружающей сердце) и ушивания расщепленной створки митрального клапана. Понятно, что это — вмешательство на открытом сердце и с помощью искусственного кровообращения. Операция хорошо разработана и риск ее такой же, как и при закрытии обычного межпредсердного сообщения, т.е. практически ничтожен.
Клинически порок протекает тяжело. Симптомы сердечной недостаточности появляются уже в первые месяцы жизни, и состояние ребенка требует постоянной лекарственной поддержки. Сердце быстро увеличивается в размерах — все его четыре камеры перегружены и с трудом справляются с работой. Ребенок очень болен, плохо ест и развивается, постоянно «подхватывает» простудные заболевания, часто заканчивающиеся воспалением легких. Состояние не критическое, но очень опасное. Операция необходима вскоре после точного установления диагноза.
При наличии условий для хирургического лечения можно устранить порок одномоментно в первые месяцы жизни, а если таких условий нет, можно разбить лечение на два этапа, т.е. вначале сузить легочную артерию (как при ДМЖП ), а через несколько месяцев сделать радикальную операцию.
Суть коррекции порока состоит вот в чем. В условиях «открытого сердца» рассекают общие створки клапана пополам, чтобы создать два отдельных входа в правый и левый желудочки. Затем с помощью заплаты закрывают дефект межжелудочковой перегородки. К этой заплате пришивают рассеченные ранее части общих створок, создавая тем самым правое и левое предсердно-желудочковые отверстия. Затем, отдельной заплатой закрывают межпредсердную часть бывшего дефекта.
Работы тут много, и требуется достаточно длительное время и на саму операцию, и на использование аппарата искусственного кровообращения. Вместе с тем, возможности ведущих клиник, специализирующихся на хирургическим лечении пороков у грудных детей, позволяют делать эту операцию в младенческом возрасте. Операции на ранних сроках абсолютно оправданы, т.к. позволяют избегнуть многих осложнений, которые уже трудно или невозможно исправить. Сегодня операция достаточно отработана и стандартна, а результаты ее хорошие.
Однако… Вечное это «однако» в медицине… Когда хирург работает на створках клапана, которые особенно у маленьких детей представляют собой тончайшие прозрачные лепестки, то любой, даже самый тонкий материал для швов, оказывается слишком грубым. Кроме того, ребенок будет расти, а сердце — и его клапанные отверстия — увеличиваться по мере роста. Поэтому, чем раньше сделана операция, тем более вероятно, что когда-нибудь его атрио-вентрикулярные клапаны, особенно митральный, будут работать несовершенно, т.е. появится их недостаточность. Это может произойти даже после идеально сделанной первой операции. В какой-то момент подростковой или уже взрослой жизни может быть поставлен вопрос об устранении недостаточности хирургическим путем: пластикой или протезированием клапана. Но это, если и будет, то гораздо позже. Здесь мы хотим подчеркнуть, что ребенка, удачно оперированного по поводу полной формы АВК надо регулярно показывать кардиологу и следить за функцией его клапанов, которая с годами может меняться.
Это совсем не означает, что нужно ограждать ребенка от физических нагрузок и внушать ему, что у него больное сердце, ни в коем случае. Но заниматься, например, большим спортом, который сегодня подразумевает нагрузки на грани возможностей здорового человека, ему, наверное, все-таки не стоит. Впрочем, наблюдение за ним грамотным детским кардиологом является залогом того, что все будет сделано вовремя.
Один из создателей кардиохирургии доктор Джон Кирклин однажды сказал: «По-моему, это самая красивая операция из всех, что делаются по поводу врожденных пороков сердца». И пусть она будет для вашего ребенка не только самой красивой, но и самой удачной.
Дефект предсердно-желудочковой перегородки (Q21.2)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
А триовентрикулярный канал — (canalis atrioventricularis, LNE; син. предсердно желудочковый канал) канал, соединяющий предсердие и желудочек в эмбриональном сердце; по мере развития сердечных перегородок на месте канала формируются предсердно желудочковые отверстия.
35 % пациентов с АВК — пациенты с синдромом Дауна, при этом у них чаще всего отмечается полная форма ДАВП (у более 75 % пациентов). Частичная форма ДАВП чаще отмечается у пациентов без синдрома Дауна (> 90 % пациентов). ДАВП также может сочетаться с тетрадой Фалло и другими формами сложных пороков сердца. Очень часто наблюдается при транспозиции органов.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Порок связан с нарушением развития перегородки сердца и атриовентрикулярных клапанов.
Гемодинамика. Артериовенозный сброс крови при неполной форме АВК идет на уровне предсердий, одновременно через расщепленную створку митрального клапана поток крови направлен из левого желудочка в левое предсердие (митральная недостаточность). При полной форме АВК шунт возникает на уровне предсердий и желудочков в сочетании с недостаточностью митрального клапана. Часто сопутствует недостаточность клапанов легочной артерии.
В связи с большим ДМПП сброс крови на уровне предсердий определяется диастолическим расслаблением желудочков. Иногда сброс крови направлен из левого желудочка непосредственно в правое предсердие (косой канал, или левожелудочково-правопредсердное сообщение). Величина сброса на уровне желудочков определяется соотношением сопротивлений в малом и большом кругах кровообращения.
Эпидемиология
Порок встречается преимущественно у детей первых лет жизни, так как из-за тяжелых гемодинамических нарушений большинство больных рано умирают.
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
— наличие детей с врожденными пороками сердца (ВПС);
— наличие ВПС у отца или ближайших родственников;
— наследственные заболевания в семье.
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Клиническая картина несколько отличается в зависимости от формы АВК:
Неполная форма
Клиническая картина порока по характеру, времени появления симптомов во многом схожа с клиникой у больных с вторичными ДМПП. Вместе с тем симптомы могут появиться уже в первые годы жизни; в дальнейшем состояние больных ухудшается. Тяжесть состояния больных зависит от величины первичного ДМПП и степени недостаточности митрального клапана.Жалобы больных на отставание в физическом развитии, одышку при физической нагрузке, частые респираторные заболевания могут быть при любом пороке сердца со сбросом крови слева направо. В типичных случаях это бледные, худые дети 4−7−летнего возраста с небольшой асимметрией грудной клетки за счет выбухания левой ее половины.
При физикальном обследовании размеры сердца увеличены, иногда при пальпации над верхушкой определяется систолическое дрожание. Признаки недостаточности кровообращения наблюдаются приблизительно у половины больных. При аускультации I тон над верхушкой обычно усилен, II тон расщеплен, но не акцентирован. Во втором выслушивается систолический шум, характерный для дефекта, а над для митральной недостаточности.
Диагностика
При эхокардиографическом исследовании у детей с неполной АВК обнаруживаются признаки первичного ДМПП (перерыв эхосигнала от перегородки), аномалии митрального клапана (сближение фиброзного кольца клапана и межжелудочковой перегородки, эхо от передней створки прослеживается до перед ней стенки аорты, дополнительные эхосигналы от аномально прикрепленных к межжелудочковой перегородке хорд расщепленной передней митральной створки и др.), признаки изменения трикуспидального клапана (систолический сегмент кривой клапана начинается непосредственно над межжелудочковой перегородкой), эхопризнаки объемной перегрузки правого желудочка. Размеры полости левого желудочка различны. При полной форме АВК митральный и трикуспидальный клапаны пересекают перегородку, ее движение нормальное, имеются признаки ДМЖП.
При катетеризации полостей сердца при неполной форме отмечается «низкое» положение зонда при прохождении его в левые отделы через ДМПП (при исследовании через сосуды бедра). Фиксируется значительное повышение насыщения крови кислородом, начинающееся на уровне правого предсердия. Насыщение артериальной крови в пределах нормы, т. е. имеет место однонаправленный сброс крови слева направо. Давление в правых полостях сердца и в легочной артерии нормальное или слегка повышено. При выраженной недостаточности клапана может быть повышено давление в легочных капиллярах. Общелегочное сопротивление обычно не меняется, а соотношение величины кровотока в малом и большом круге кровообращения составляет 2:1.
При полной форме при катетеризации полостей сердца определяются большой сброс крови слева направо, определенная степень артериальной гипоксемии, повышение давления в малом круге кровообращения, которое часто достигает уровня системного. Давление в легочных капиллярах может быть повышено.
Дифференциальный диагноз
Осложнения
Лечение
Всем больным с признаками сердечной недостаточности показаны сердечные гликозиды и мочегонные препараты Эффект часто бывает незначительным, в связи с чем возникает необходимость в ранней хирургической коррекции порока.
Прогноз
Беременность. Пациентки с полностью восстановленной перегородкой без серьезных остаточных явлений хорошо переносят беременность. При неоперированном частичном ДАВП отмечается повышенный риск развития парадоксальной эмболии. В ходе планирования беременности желательно провести закрытие любого значительного дефекта межпредсердной перегородки. Пациентам с легочной гипертензией тяжелой степени беременность противопоказана. Как правило, пациентки с остаточной недостаточностью левого атриовентрикулярного клапана без показаний к хирургической коррекции переносят беременность относительно хорошо, однако возможно развитие аритмии и ухудшение недостаточности атриовентрикулярного клапана Вероятность рождения ребенка с пороком сердца довольно высокая (до 11 %), поэтому необходимо генетическое консультирование
Профилактика
Профилактика возникновения врожденных пороков сердца (ВПС) очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди людей, относящихся к группе повышенного риска заболевания. К примеру, в случае, когда 3 человека, состоящие в прямом родстве, имеют ВПС, вероятность появления следующего случая составляет 65-100% и беременность не рекомендуется. Нежелателен брак между двумя людьми с ВПС. Помимо этого необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, которая может привести к развитию ВПС.
Профилактика неблагоприятного развития ВПС:
— своевременное выявление порока;
— обеспечение надлежащего ухода за ребенком с ВПС;
— определение оптимального метода коррекции порока (чаще всего, это хирургическая коррекция).
Обеспечение необходимого ухода является важной составляющей в лечении ВПС и профилактике неблагоприятного развития, так как около половины случаев смерти детей до 1-го года во многом обуславливаются недостаточно адекватным и грамотным уходом за больным ребенком.
Специальное лечение ВПС, (в том числе, кардиохирургическое) должно проводиться в наиболее оптимальные сроки, а не немедленно по выявлению порока, и не в самые ранние сроки. Исключение составляют только критические случаи угрозы жизни ребенка. Оптимальные сроки зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.





