вторичная структура белка стабилизируется за счет связей
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Параграф 58. белки вторичная и третичная структура
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя. Курсив НЕ НУЖНО зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
ПАРАГРАФ 58:
«ВТОРИЧНАЯ И ТРЕТИЧНАЯ СТРУКТУРА белков».
(См. сначала п.56 и п.57.)
Полипептидная цепь (ППЦ) способна формировать в пространстве определённую структуру за счёт взаимодействия атомов;
эти структуры получили название вторичной и третичной структуры (см. далее).
58.1. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА.
Один из самых распространённых способов изменить конформацию и активность молекул белков – это присоединение и отщепление фосфатной группы. Эти реакции осуществляются под действием ферментов протеинкиназ и протеинфосфатаз (активность которых, в свою очередь, регулируется гормонами).
Присоединение фосфата меняет конформацию белковой молекулы потому, что фосфат имеет отрицательный заряд; присоединие фосфата приводит к тому, что к его отрицательному заряду притягиваются положительно заряженные радикалы, а отрицательно заряженные радикалы отталкиваются от отрицательного заряда фосфата.
Кратко – изменение конформации белка приводит к изменению активности белка (так как приводит к исчезновению или к появлению активного центра). Причиной изменений конформации белка является изменение условий среды, в которой находится белок, или изменение химического состава белка.
58.5. Денатурация. См. параграф 3.
Это потеря активности белка в результате разрушения третичной (или четвертичной) структуры. При этом ППЦ не разрушается, первичная структура сохраняется.
Почему происходит потеря активности – потому что при разрушении третичной структуры исчезают активные центры – из-за того, что отдаляются друг от друга РАДИКАЛЫ, формировавшие активный центр.
Под действием чего происходит денатурация и почему? – Под действием факторов, которые называют денатураторами. Примеры денатураторов:
ВЫСОКАЯ ТЕМПЕРАТУРА (нагревание; повышение температуры тела выше 37 градусов),
повышение или ПОНИЖЕНИЕ рН в результате появления кислот или щелочей (отклонение от оптимального для данного белка рН, который для большинства белков – около 7),
определённые излучения (например, РАДИАЦИЯ), определённые химические вещества, особенно гидрофобные, растворители и т.д.
Все денатураторы (например, высокая температура) ПОТЕНЦИАЛЬНО ОПАСНЫ для организма именно потому, что приводят к потере активности белков, что приводит к нарушению процессов в организме и гибели клеток.
При исчезновении денатурирующего фактора ППЦ иногда могут снова сформировать третичную структуру, что может привести к возвращению активности белка.
Вторичная, третичная, четвертичная структуры белка. Химические связи, участвующие в образовании структур белка. Биологическая роль структурной организации белковых молекул.



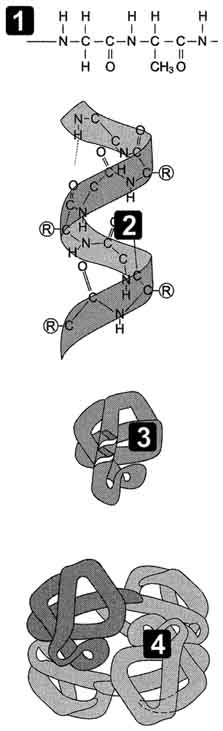
В белках различают 2 основных типа конформации полипептидных цепей: вторичную и третичную структуры.
При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спирали
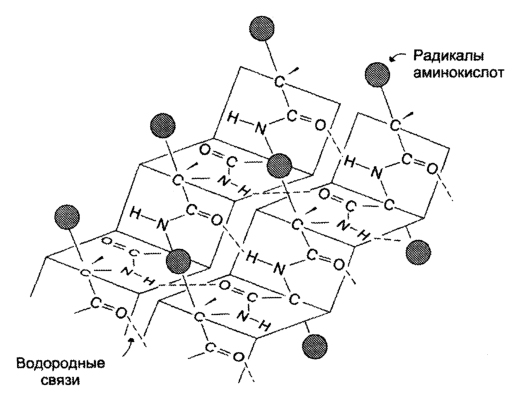
β-структрура Под β-структурой понимают фигуру, подобную листу, сложенному «гармошкой». Фигура формируется за счет образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными группами.
Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль
стабилизации третичной структуры белка принимают участие:
· ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
· ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
· гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
4. Четвертичной структурой называют взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
Роль.
Образование пептидов в организме происходит в течение нескольких минут, химический же синтез в условиях лаборатории — достаточно длительный процесс, который может занимать несколько дней, а разработка технологии синтеза – несколько лет. Однако, несмотря на это, существуют довольно весомые аргументы в пользу проведения работ по синтезу аналогов природных пептидов. Во-первых, путём химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых, синтетические пептиды позволяют подробнее изучить связь между структурой аминокислотной последовательности и её активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить её направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих, благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов позволяет выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвёртых, химический синтез пептидов экономически выгоден. Большинство терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
Зачастую активные пептиды в природе обнаруживаются лишь в нанограммовых количествах. Плюс к этому, методы очистки и выделения пептидов из природных источников не могут полностью разделить искомую аминокислотную последовательность с пептидами противоположного или же иного действия. А в случае специфических пептидов, синтезируемых организмом человека, получить их возможно лишь путём синтеза в лабораторных условиях.
57. Классификация белков: простые и сложные, глобулярные и фибриллярные, мономерные и олигомерные. Функции белков в организме.
Классификация по типу строения
По общему типу строения белки можно разбить на три группы:
1. Фибриллярные белки — образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. К фибриллярным белкам относятся кератин и коллаген.
2. Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая.
3. Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортёры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
Простые белки, Сложные белки
Помимо пептидных цепей, в состав многих белков входят и неаминокислотные группы, и по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки состоят только из полипептидных цепей, сложные белки содержат также неаминокислотные, или простетические, группы.
Простые.
Среди глобулярных белков можно выделить:
1. альбумины — растворимы в воде в широком интервале рН (от 4 до 8,5), осаждаются 70-100%-ным раствором сульфата аммония;
2. полифункциональные глобулины с большей молекулярной массой, труднее растворимы в воде, растворимы в солевых растворах, часто содержат углеводную часть;
3. гистоны — низкомолекулярные белки с высоким содержанием в молекуле остатков аргинина и лизина, что обусловливает их основные свойства;
4. протамины отличаются еще более высоким содержанием аргинина (до 85 %), как и гистоны, образуют устойчивые ассоциаты с нуклеиновыми кислотами, выступают как регуляторные и репрессорные белки — составная часть нуклеопротеинов;
5. проламины характеризуются высоким содержанием глутаминовой кислоты (30-45 %) и пролина (до 15 %), нерастворимы в воде, растворяются в 50-90 % этаноле;
6. глутелины содержат около 45 % глутаминовой кислоты, как и проламины, чаще содержатся в белках злаков.
Фибриллярные белки характеризуются волокнистой структурой, практически нерастворимы в воде и солевых растворах. Полипептидные цепи в молекулах расположены параллельно одна другой. Участвуют в образовании структурных элементов соединительной ткани (коллагены, кератины, эластины).
Сло?жные белки?
(протеиды, холопротеины) — двухкомпонентные белки, в которых помимо пептидных цепей (простого белка) содержится компонент неаминокислотной природы — простетическая группа. При гидролизе сложных белков, кроме аминокислот, освобождается небелковая часть или продукты её распада.
В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества.
В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы [1] :
· Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет
95 %, они являются основным компонентом межклеточного матрикса.
· Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
· Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
· Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока [3] :
· Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относится множество белков с металлсодержащейпорфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы;флавопротеиды с флавиновой группой, и др.
Строение белков. Структуры белков
Структуры белков: первичная, вторичная, третичная и четвертичная
Белки
Название «белки» происходит от способности многих из них при нагревании становиться белыми. Название «протеины» происходит от греческого слова «первый», что указывает на их важное значение в организме. Чем выше уровень организации живых существ, тем разнообразнее состав белков.
Белки образуются из аминокислот, которые соединяются между собой ковалентной – пептидной связью: между карбоксильной группой одной аминокислоты и аминогруппой другой. При взаимодействии двух аминокислот образуется дипептид (из остатков двух аминокислот, от греч. пептос – сваренный). Замена, исключение или перестановка аминокислот в полипептидной цепи вызывает возникновение новых белков. Например, при замене лишь одной аминокислоты (глутамина на валин) возникает тяжелая болезнь – серповидно-клеточная анемия, когда эритроциты имеют другую форму и не могут выполнять свои основные функции (перенос кислорода). При образовании пептидной связи отщепляется молекула воды. В зависимости от количества аминокислотных остатков выделяют:
– олигопептиды (ди-, три-, тетрапептиды и т. п.) – содержат до 20 аминокислотных остатков;
– полипептиды – от 20 до 50 аминокислотных остатков;
– белки – свыше 50, иногда тысячи аминокислотных остатков
По физико-химическим свойствам различают белки гидрофильные и гидрофобные.
Существуют четыре уровня организации белковой молекулы – равноценные пространственные структуры (конфигурации, конформации) белков: первичная, вторичная, третичная и четвертичная.
Первичная структура
Первичная структура белков является простейшей. Имеет вид полипептидной цепи, где аминокислоты связаны между собой прочной пептидной связью. Определяется качественным и количественным составом аминокислот и их последовательностью.
Вторичная структура
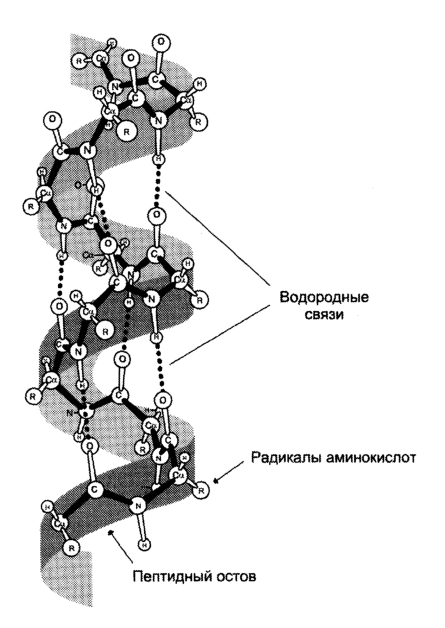
Вторичная структура образована преимущественно водородными связями, которые образовались между атомами водорода NH-группы одного завитка спирали и кислорода СО-группы другого и направлены вдоль спирали или между параллельными складками молекулы белка. Белковая молекула частично или целиком скручена в α-спираль или образует β-складчатую структуру. Например, белки кератина образуют α-спираль. Они входят в состав копыт, рогов, волос, перьев, ногтей, когтей. β-складчатую имеют белки, которые входят в состав шелка. Извне спирали остаются аминокислотные радикалы (R-группы). Водородные связи значительно более слабые, чем ковалентные, но при значительном их количестве образуют довольно прочную структуру.
Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков – миозин, актин, фибриноген, коллаген и т. п.
Третичная структура
Третичная структура белка. Эта структура постоянна и своеобразна для каждого белка. Она определяется размером, полярностью R-групп, формой и последовательностью аминокислотных остатков. Полипептидная спираль закручивается и укладывается определенным образом. Формирование третичной структуры белка приводит к образованию особой конфигурации белка – глобулы (от лат. globulus – шарик). Его образование обуславливается разными типами нековалентных взаимодействий: гидрофобные, водородные, ионные. Между остатками аминокислоты цистеина возникают дисульфидные мостики.
Гидрофобные связи – это слабые связи между неполярными боковыми цепями, которые возникают в результате взаимного отталкивания молекул растворителя. При этом белок скручивается так, что гидрофобные боковые цепи погружены вглубь молекулы и защищают ее от взаимодействия с водой, а снаружи расположены боковые гидрофильные цепи.
Третичную структуру имеет большинство белков – глобулины, альбумины и т. п.
Четвертичная структура
Четвертичная структура белка. Образуется в результате объединения отдельных полипептидных цепей. В совокупности они составляют функциональную единицу. Типы связей разные: гидрофобные, водородные, электростатические, ионные.
Электростатические связи возникают между электроотрицательными и электроположительными радикалами аминокислотных остатков.
Для одних белков характерно глобулярное размещение субъединиц – это глобулярные белки. Глобулярные белки легко растворяются в воде или растворах солей. К глобулярным белкам принадлежит свыше 1000 известных ферментов. К глобулярным белкам относятся некоторые гормоны, антитела, транспортные белки. Например, сложная молекула гемоглобина (белка эритроцита крови) является глобулярным белком и состоит из четырех макромолекул глобинов: двух α-цепей и двух β-цепей, каждая из которых соединена с гемом, содержащим железо.
Для других белков характерно объединение в спиральные структуры – это фибриллярные (от лат. fibrilla – волоконце) белки. Несколько (от 3 до 7) α–спиралей свиваются вместе, подобно волокнам в кабеле. Фибриллярные белки нерастворимы в воде.
Белки делят на простые и сложные.
Простые (протеины)
Состоят только из остатков аминокислот. К простым белкам относят глобулины, альбумины, глутелины, проламины, протамины, пистоны. Альбумины (например, альбумин сыворотки крови) растворимы в воде, глобулины (например, антитела) нерастворимы в воде, но растворимы в водных растворах некоторых солей (хлорид натрия и т. п.).
Сложные (протеиды)
Включают в состав, кроме остатков аминокислот, соединения другой природы, которые называются простетическою группой. Например, металлопротеиды – это белки, содержащие негеминовое железо или связанные атомами металлов (большинство ферментов), нуклеопротеиды – белки, соединенные с нуклеиновыми кислотами (хромосомы и т. п.), фосфопротеиды –белки, в состав которых входят остатки фосфорной кислоты (белки яичного желтка и т. п.), гликопротеиды –белки в соединении с углеводами (некоторые гормоны, антитела и т. п.), хромопротеиды – белки, содержащий пигменты (миоглобин и т. п.), липопротеиды – белки, содержащие липиды (входят в состав мембран).
Вторичная структура белка
Содержание
Вторичная структура белка [ править | править код ]
Вторичную структуру белка определяют водородные связи между атомами, образующими пептидную связь. Третичная структура белков обусловлена связями между радикалами аминокислот.
β-Цепь и β-слой [ править | править код ]
По своей структуре полипептидная цепь может быть организована как β-цепь. Когда несколько таких β-цепей связываются друг с другом, они формируют параллельный или антипараллельный β-слой.
Рис. 7.1. Антипараллельный β-слой. Полипептидная цепь существует в виде зигзагообразной β-цепи. β-Цепи могут связываться друг с другом водородными связями, образуя β-слой. Если соседние β-цепи в β-слое ориентированы противоположно, эта структура называется «антипараллельный β-слой»
Рис. 7.2. Параллельный β-слой. Три β-цепи связываются водородными связями, формируя р-складчатый слой. Поскольку β-цепи ориентированы в одном направлении, β-слой называется параллельным
α-Спираль [ править | править код ]
Полипептидные цепи стабилизируются водородными связями с образованием правозакрученной а-спирали (рис. 7.3).
При изменениях первичной структуры белка меняется и его вторичная структура: так, делеция одной аминокислоты вызывает муковисцидоз
Первичной структурой белка называют последовательность аминокислот в пептидной цепи. Всего лишь одна неправильная аминокислота в цепи из 1480 аминокислот может изменить функции белка. Именно это происходит при муковисцидозе. Это врожденное заболевание, при котором нарушена структура гена CFRT (cystic fibrosis transmembrane conductance regulator — трансмембранный регулятор проводимости при муковисцидозе). Продукт этого гена — трансмембранный белок, который в норме выполняет функцию транспортера для ионов хлорида; однако в случае муковисцидоза его функции нарушаются. Самая распространенная причина муковисцидоза, которая наблюдается у 70% больных, — делеция трех пар оснований в гене CFRT, из-за чего мутантный белок CFRT не содержит фенилаланина в положении 508 (рис. 7.4). Эта мутация называется ДР508-мутацией (А — делеция, F — фенилаланин, 508 — положение фенилаланина в первичной структуре белка). После синтеза дефектный CFTR-белок сворачивается в неправильную вторичную структуру и удерживается в эндоплазматическом ретикулуме. Из-за отсутствия транспортера для ионов хлора клетки секретируют густую вязкую слизь, которая накапливается в дыхательных путях и нарушает функционирование легких. Кроме того, нарушается экзокринная функция поджелудочной железы, что проявляется в синдроме мальабсорбции.
Перестройка вторичной структуры приона вызывает губчатую энцефалопатию (болезнь Крейтцфельда-Якоба, «коровье бешенство»)
Рис. 7.3. Правозакрученная α-спираль
Рис. 7.4. Мутация AF508 вызывает муковисцидоз. Из-за делеции трех оснований — СТТ — в белке CFRT отсутствует фенилаланин в позиции 508. Функции такого белка нарушены, и вследствие этого развивается муковисцидоз. Примечание: делеция основания не влияет на изолейцин в позиции 507, так как и АТС, и ATT кодируют изолейцин
Рис. 7.5. Белки прионы. В норме белок прион (РrР с ) растворим и состоит в основном из а-спиралей. Но в мутантной форме приона, которая вызывает почесуху (РrР sc ), часть а-спиралей переходит в р-складчатую конформацию, и белок становится нерастворимым. Мутантная форма РrР sc «инфекционна», так как в ее присутствии а-спирали трансформируются в β-конформацию