вторичная структура белковых молекул стабилизируется за счет
Вторичная структура белковых молекул стабилизируется за счет
Для всякого белка характерна, помимо первичной, еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину.
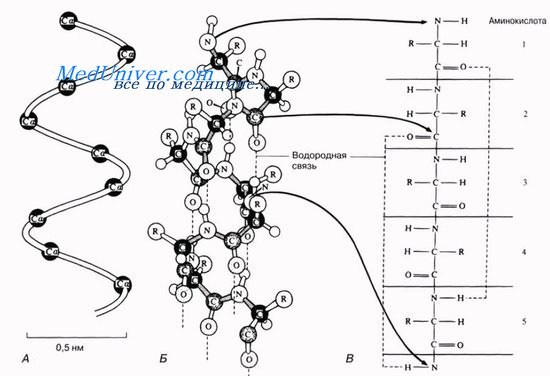
Это так называемая а-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка.
Таким образом аминокислота 1 оказывается связанной с аминокислотой 5, аминокислота 2 — с аминокислотой 6 и т. д. Рентгеноструктурный анализ показывает, что на один виток спирали приходится 3,6 аминокислотного остатка.
Полностью а-спиральную конформацию и, следовательно, фибриллярную структуру имеет белок кератин. Это структурный белок волос, шерсти, ногтей, клюва, перьев и рогов, входящий также в состав кожи позвоночных.
Твердость и растяжимость кератина варьируют в зависимости от числа дисульфидных мостиков между соседними полипептидными цепями (от степени сшивки цепей).
Теоретически все СО- и NH-группы могут участвовать в образовании водородных связей, так что а-спираль — это очень устойчивая, а потому и весьма распространенная конформация. Участки а-спирали в молекуле напоминают жесткие стержни. Тем не менее большинство белков существует в глобулярной форме, в которой также имеются участки (3-слоя (см. ниже) и участки с нерегулярной структурой.
Объясняется это тем, что образованию водородных связей препятствует ряд факторов: наличие некоторых аминокислотных остатков в полипептидной цепи, наличие дисульфидных мостиков между различными участками одной и той же цепи и, наконец, тот факт, что аминокислота пролин вообще неспособна образовывать водородные связи.
Бета-Слой, или складчатый слой — это другой тип вторичной структуры. Белок шелка фиброин, выделяемый шелкоотделительными железами гусениц шелкопряда при завивке коконов, представлен целиком именно этой формой. Фиброин состоит из ряда полипептидных цепей, вытянутых сильнее, чем цепи с конформацией альфа-спирали.
Эти цепи уложены параллельно, но соседние цепи по своему направлению противоположны одна другой (антипараллельны). Они соединены друг с другом при помощи водородных связей, возникающих между С=0- и NH-группами соседних цепей. В этом случае в образовании водородных связей также принимают участие все NH- и С=0-группы, т. е. структура тоже весьма стабильна.
Такая конформация полипептидных цепей называется бета-конформацией, а структура в целом — складчатым слоем. Фиброин обладает высокой прочностью на разрыв и не поддается растяжению, но подобная организация полипептидных цепей делает шелк очень гибким. В глобулярных белках полипептидная цепь может складываться на себя, и тогда в этих точках глобулы возникают участки, имеющие структуру складчатого слоя.
Еще один способ организации полипептидных цепей мы находим у фибриллярного белка коллагена. Это тоже структурный белок, обладающий подобно кератину и фиброину высокой прочностью на разрыв. У коллагена три полипептидные цепи свиты вместе, как пряди в канате, образуя тройную спираль. В каждой полипептидной цепи этой сложной спирали, называемой тропоколлагеном, содержится около 1000 аминокислотных остатков. Отдельная полипептидная цепь представляет собой свободно свернутую спираль (но не а-спираль;).
Три цепи удерживаются вместе водородными связями. Из многих тройных спиралей, располагающихся параллельно друг другу и удерживаемых вместе ковалентными связями между соседними цепями, образуются фибриллы. Они в свою очередь объединяются в волокна. Структура коллагена формируется, таким образом, поэтапно — на нескольких уровнях — подобно структуре целлюлозы. Коллаген также невозможно растянуть, и это его свойство существенно для той функции, которую он выполняет, например, в сухожилиях, костях и других видах соединительной ткани.
Белки, существующие только в полностью спирализованной форме, подобно кератину и коллагену, представляют собой исключение среди прочих белков.
Параграф 58. белки вторичная и третичная структура
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя. Курсив НЕ НУЖНО зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
ПАРАГРАФ 58:
«ВТОРИЧНАЯ И ТРЕТИЧНАЯ СТРУКТУРА белков».
(См. сначала п.56 и п.57.)
Полипептидная цепь (ППЦ) способна формировать в пространстве определённую структуру за счёт взаимодействия атомов;
эти структуры получили название вторичной и третичной структуры (см. далее).
58.1. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА.
Один из самых распространённых способов изменить конформацию и активность молекул белков – это присоединение и отщепление фосфатной группы. Эти реакции осуществляются под действием ферментов протеинкиназ и протеинфосфатаз (активность которых, в свою очередь, регулируется гормонами).
Присоединение фосфата меняет конформацию белковой молекулы потому, что фосфат имеет отрицательный заряд; присоединие фосфата приводит к тому, что к его отрицательному заряду притягиваются положительно заряженные радикалы, а отрицательно заряженные радикалы отталкиваются от отрицательного заряда фосфата.
Кратко – изменение конформации белка приводит к изменению активности белка (так как приводит к исчезновению или к появлению активного центра). Причиной изменений конформации белка является изменение условий среды, в которой находится белок, или изменение химического состава белка.
58.5. Денатурация. См. параграф 3.
Это потеря активности белка в результате разрушения третичной (или четвертичной) структуры. При этом ППЦ не разрушается, первичная структура сохраняется.
Почему происходит потеря активности – потому что при разрушении третичной структуры исчезают активные центры – из-за того, что отдаляются друг от друга РАДИКАЛЫ, формировавшие активный центр.
Под действием чего происходит денатурация и почему? – Под действием факторов, которые называют денатураторами. Примеры денатураторов:
ВЫСОКАЯ ТЕМПЕРАТУРА (нагревание; повышение температуры тела выше 37 градусов),
повышение или ПОНИЖЕНИЕ рН в результате появления кислот или щелочей (отклонение от оптимального для данного белка рН, который для большинства белков – около 7),
определённые излучения (например, РАДИАЦИЯ), определённые химические вещества, особенно гидрофобные, растворители и т.д.
Все денатураторы (например, высокая температура) ПОТЕНЦИАЛЬНО ОПАСНЫ для организма именно потому, что приводят к потере активности белков, что приводит к нарушению процессов в организме и гибели клеток.
При исчезновении денатурирующего фактора ППЦ иногда могут снова сформировать третичную структуру, что может привести к возвращению активности белка.
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Строение белков. Структуры белков
Структуры белков: первичная, вторичная, третичная и четвертичная
Белки
Название «белки» происходит от способности многих из них при нагревании становиться белыми. Название «протеины» происходит от греческого слова «первый», что указывает на их важное значение в организме. Чем выше уровень организации живых существ, тем разнообразнее состав белков.
Белки образуются из аминокислот, которые соединяются между собой ковалентной – пептидной связью: между карбоксильной группой одной аминокислоты и аминогруппой другой. При взаимодействии двух аминокислот образуется дипептид (из остатков двух аминокислот, от греч. пептос – сваренный). Замена, исключение или перестановка аминокислот в полипептидной цепи вызывает возникновение новых белков. Например, при замене лишь одной аминокислоты (глутамина на валин) возникает тяжелая болезнь – серповидно-клеточная анемия, когда эритроциты имеют другую форму и не могут выполнять свои основные функции (перенос кислорода). При образовании пептидной связи отщепляется молекула воды. В зависимости от количества аминокислотных остатков выделяют:
– олигопептиды (ди-, три-, тетрапептиды и т. п.) – содержат до 20 аминокислотных остатков;
– полипептиды – от 20 до 50 аминокислотных остатков;
– белки – свыше 50, иногда тысячи аминокислотных остатков
По физико-химическим свойствам различают белки гидрофильные и гидрофобные.
Существуют четыре уровня организации белковой молекулы – равноценные пространственные структуры (конфигурации, конформации) белков: первичная, вторичная, третичная и четвертичная.
Первичная структура
Первичная структура белков является простейшей. Имеет вид полипептидной цепи, где аминокислоты связаны между собой прочной пептидной связью. Определяется качественным и количественным составом аминокислот и их последовательностью.
Вторичная структура
Вторичная структура образована преимущественно водородными связями, которые образовались между атомами водорода NH-группы одного завитка спирали и кислорода СО-группы другого и направлены вдоль спирали или между параллельными складками молекулы белка. Белковая молекула частично или целиком скручена в α-спираль или образует β-складчатую структуру. Например, белки кератина образуют α-спираль. Они входят в состав копыт, рогов, волос, перьев, ногтей, когтей. β-складчатую имеют белки, которые входят в состав шелка. Извне спирали остаются аминокислотные радикалы (R-группы). Водородные связи значительно более слабые, чем ковалентные, но при значительном их количестве образуют довольно прочную структуру.
Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков – миозин, актин, фибриноген, коллаген и т. п.
Третичная структура
Третичная структура белка. Эта структура постоянна и своеобразна для каждого белка. Она определяется размером, полярностью R-групп, формой и последовательностью аминокислотных остатков. Полипептидная спираль закручивается и укладывается определенным образом. Формирование третичной структуры белка приводит к образованию особой конфигурации белка – глобулы (от лат. globulus – шарик). Его образование обуславливается разными типами нековалентных взаимодействий: гидрофобные, водородные, ионные. Между остатками аминокислоты цистеина возникают дисульфидные мостики.
Гидрофобные связи – это слабые связи между неполярными боковыми цепями, которые возникают в результате взаимного отталкивания молекул растворителя. При этом белок скручивается так, что гидрофобные боковые цепи погружены вглубь молекулы и защищают ее от взаимодействия с водой, а снаружи расположены боковые гидрофильные цепи.
Третичную структуру имеет большинство белков – глобулины, альбумины и т. п.
Четвертичная структура
Четвертичная структура белка. Образуется в результате объединения отдельных полипептидных цепей. В совокупности они составляют функциональную единицу. Типы связей разные: гидрофобные, водородные, электростатические, ионные.
Электростатические связи возникают между электроотрицательными и электроположительными радикалами аминокислотных остатков.
Для одних белков характерно глобулярное размещение субъединиц – это глобулярные белки. Глобулярные белки легко растворяются в воде или растворах солей. К глобулярным белкам принадлежит свыше 1000 известных ферментов. К глобулярным белкам относятся некоторые гормоны, антитела, транспортные белки. Например, сложная молекула гемоглобина (белка эритроцита крови) является глобулярным белком и состоит из четырех макромолекул глобинов: двух α-цепей и двух β-цепей, каждая из которых соединена с гемом, содержащим железо.
Для других белков характерно объединение в спиральные структуры – это фибриллярные (от лат. fibrilla – волоконце) белки. Несколько (от 3 до 7) α–спиралей свиваются вместе, подобно волокнам в кабеле. Фибриллярные белки нерастворимы в воде.
Белки делят на простые и сложные.
Простые (протеины)
Состоят только из остатков аминокислот. К простым белкам относят глобулины, альбумины, глутелины, проламины, протамины, пистоны. Альбумины (например, альбумин сыворотки крови) растворимы в воде, глобулины (например, антитела) нерастворимы в воде, но растворимы в водных растворах некоторых солей (хлорид натрия и т. п.).
Сложные (протеиды)
Включают в состав, кроме остатков аминокислот, соединения другой природы, которые называются простетическою группой. Например, металлопротеиды – это белки, содержащие негеминовое железо или связанные атомами металлов (большинство ферментов), нуклеопротеиды – белки, соединенные с нуклеиновыми кислотами (хромосомы и т. п.), фосфопротеиды –белки, в состав которых входят остатки фосфорной кислоты (белки яичного желтка и т. п.), гликопротеиды –белки в соединении с углеводами (некоторые гормоны, антитела и т. п.), хромопротеиды – белки, содержащий пигменты (миоглобин и т. п.), липопротеиды – белки, содержащие липиды (входят в состав мембран).
Вторичная структура белковых молекул стабилизируется за счет
§ 8. ПРОСТРАНСТВЕННАЯ ОРГАНИЗАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ
Первичная структура
Под первичной структурой белка понимают количество и порядок чередования аминокислотных остатков, соединенных друг с другом пептидными связями, в полипептидной цепи.
Полипептидная цепь на одном конце содержит свободную, не участвующую в образовании пептидной связи, NH2-группу, этот участок обозначается как N–конец. На противоположной стороне располагается свободная, не участвующая в образовании пептидной связи, НООС-группа, это – С-конец. За начало цепи принимается N-конец, именно с него начинается нумерация аминокислотных остатков:
Аминокислотную последовательность инсулина установил Ф. Сэнгер (Кембриджский университет). Этот белок состоит из двух полипептидных цепей. Одна цепь состоит из 21 аминокислотного остатка, другая цепь – из 30. Цепи связаны двумя дисульфидными мостиками (рис.6).
Рис. 6. Первичная структура инсулина человека
На расшифровку этой структуры было затрачено 10 лет (1944 – 1954 гг.). В настоящее время первичная структура определена у многих белков, процесс ее определения автоматизирован и не представляет собой серьезную проблему для исследователей.
Информация о первичной структуре каждого белка закодирована в гене (участке молекулы ДНК) и реализуется в ходе транскрипции (переписывании информации на мРНК) и трансляции (синтеза полипептидной цепи). В связи с этим можно установить первичную структуру белка также по известной структуре соответствующего гена.
По первичной структуре гомологичных белков можно судить о таксономическом родстве видов. К гомологичным белкам относятся те белки, которые у разных видов выполняют одинаковые функции. Такие белки имеют сходные аминокислотные последовательности. Например, белок цитохром С у большинства видов имеет относительную молекулярную массу около 12500 и содержит около 100 аминокислотных остатков. Различия в первичной структуре цитохрома С двух видов пропорциональны филогенетическому различию между данными видами. Так цитохромы С лошади и дрожжей отличаются по 48 аминокислотным остаткам, курицы и утки – по двум, цитохромы же курицы и индейки идентичны.
Вторичная структура
Вторичная структура белка формируется вследствие образования водородных связей между пептидными группами. Различают два типа вторичной структуры: α-спираль и β-структура (или складчатый слой). В белках могут присутствовать также участки полипептидной цепи, не образующие вторичную структуру.
α-Спираль по форме напоминает пружину. При формировании α-спирали атом кислорода каждой пептидной группы образует водородную связь с атомом водорода четвертой по ходу цепи NH-группы:
Каждый виток спирали связан со следующим витком спирали несколькими водородными связями, что придает структуре значительную прочность. α-Спираль обладает следующими характеристиками: диаметр спирали 0,5 нм, шаг спирали – 0,54 нм, на один виток спирали приходится 3,6 аминокислотных остатка (рис. 7).
Рис. 7. Модель a-спирали, отражающая ее количественные характеристики
Боковые радикалы аминокислот направлены наружу от 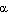
Рис. 8. Модель 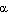
Из природных L-аминокислот может быть построена как правая, так и левая 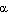
Некоторые аминокислотные остатки препятствуют образованию α-спирали. Например, если в цепи подряд расположено несколько положительно или отрицательно заряженных аминокислотных остатков, такой участок не примет α-спиральной структуры из-за взаимного отталкивания одноименно заряженных радикалов. Затрудняют образование 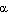
Рис. 9. Остаток пролина препятствует образованию 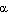
Поэтому остаток пролина, входящий в состав полипептидной цепи, не способен образовывать внутрицепочечную водородную связь. Кроме того, атом азота в пролине входит в состав жесткого кольца, что делает невозможным вращение вокруг связи N – C и образование спирали.
Кроме α-спирали описаны и другие типы спиралей. Однако они встречаются редко, в основном на коротких участках.
Образование водородных связей между пептидными группами соседних полипептидных фрагментов цепей приводит к формированию β-структуры, или складчатого слоя:
В отличие от α-спирали складчатый слой имеет зигзагообразную форму, похожую на гармошку (рис. 10).
Рис. 10. β-Структура белка
Различают параллельные и антипараллельные складчатые слои. Параллельные β-структуры образуются между участками полипептидной цепи, направления которых совпадают:
Антипаралельные β-структуры образуются между противоположно направленными участками полипептидной цепи:
β-Структуры могут формироваться более чем между двумя полипептидными цепями:
В составе одних белков вторичная структура может быть представлена только α-спиралью, в других – только β-структурами (параллельными, или антипараллельными, или и теми, и другими), в третьих наряду с α-спирализованными участками могут присутствовать и β-структуры.
Третичная структура
У многих белков вторичноорганизованные структуры (α-спирали, 
Третичная структура белков определяется их аминокислотной последовательностью. При ее формировании связи могут возникать между аминокислотами, расположенными в полипептидной цепи на значительном расстоянии. У растворимых белков полярные радикалы аминокислот, как правило, оказываются на поверхности белковых молекул и реже – внутри молекулы, гидрофобные радикалы оказываются компактно упакованными внутри глобулы, образуя гидрофобные области.
В настоящее время третичная структура многих белков установлена. Рассмотрим два примера.
Миоглобин – кислород-связывающий белок с относительной массой 16700. Его функция – запасание кислорода в мышцах. В его молекуле имеется одна полипептидная цепь, состоящая из 153 аминокислотных остатков, и гемогруппа, играющая важную роль в связывании кислорода.
Пространственная организация миоглобина установлена благодаря работам Джона Кендрью и его коллег (рис. 11). В молекуле этого белка присутствуют 8 α-спиральных участков, на их долю приходится 80 % всех аминокислотных остатков. Молекула миоглобина очень компактна, внутри нее может уместиться всего четыре молекулы воды, почти все полярные радикалы аминокислот расположены на внешней поверхности молекулы, большая часть гидрофобных радикалов расположена внутри молекулы, вблизи поверхности находится гем – небелковая группа, ответственная за связывание кислорода.
Рис.11. Третичная структура миоглобина
Рибонуклеаза – глобулярный белок. Она секретируется клетками поджелудочной железы, это – фермент, катализирующий расщепление РНК. В отличие от миоглобина, в молекуле рибонуклеазы имеется очень мало α-спиральных участков и достаточно большое число сегментов, находящихся в β-конформации. Прочность третичной структуре белка придают 4 дисульфидные связи.
Четвертичная структура
Многие белки состоят из нескольких, двух или более, белковых субъединиц, или молекул, обладающих определенной вторичной и третичной структурами, удерживаемых вместе при помощи водородных и ионных связей, гидрофобных взаимодействий, ван-дер-ваальсовых сил. Такая организация белковых молекул носит название четвертичной структуры, а сами белки называют олигомерными. Отдельная субъединица, или белковая молекула, в составе олигомерного белка называется протомером.
Число протомеров в олигомерных белках может варьировать в широких пределах. Например, креатинкиназа состоит из 2 протомеров, гемоглобин – из 4 протомеров, РНК-полимераза E.coli – фермент, ответственный за синтез РНК, – из 5 протомеров, пируватдегидрогеназный комплекс – из 72 протомеров. Если белок состоит из двух протомеров, его называют димером, четырех – тетрамером, шести – гексамером (рис. 12). Чаще в молекуле олигомерного белка содержится 2 или 4 протомера. В состав олигомерного белка могут входить одинаковые или различные протомеры. Если в состав белка входят два идентичных протомера, то это – гомодимер, если разные – гетеродимер.
Рис. 12. Олигомерные белки
Рассмотрим организацию молекулы гемоглобина. Основная функция гемоглобина заключается в транспорте кислорода из легких в ткани и углекислого газа в обратном направлении. Его молекула (рис. 13) состоит из четырех полипептидных цепей двух различных типов – двух α-цепей и двух β-цепей и гема. Гемоглобин является белком, родственным миоглобину. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны. Каждый протомер гемоглобина содержит, как и миоглобин, 8 α-спирализованных участков полипептидной цепи. При этом надо отметить, что в первичных структурах миоглобина и протомера гемоглобина идентичны только 24 аминокислотных остатка. Следовательно, белки, значительно отличающиеся по первичной структуре, могут иметь сходную пространственную организацию и выполнять сходные функции.