значение постоянной авогадро равно чему
Значение постоянной авогадро равно чему

В 1811 А.Авогадро (1776–1856) выдвинул гипотезу, которая значительно упрощала анализ того, как из элементов образуются соединения, и устанавливала различие между атомами и молекулами. Его мысль состояла в том, что равные объемы газов, находящиеся при одинаковых температуре и давлении, содержат одно и то же число молекул.
Первые экспериментальные определения числа Авогадро это опыты Жана Батиста Перрена с суспензией гуммимута. Ж.Б.Перрен в период 1908-1913гг. занимался экспериментальным исследованием броуновского движения.С помощью ультрамикроскопа Перрен наблюдал за движением частиц, отмечал и потом зарисовывал в масштабе на листе бумаге положение частиц через равные интервалы времени. Перрен провел сотни опытов с различными частицами в дисперсионных средах разной вязкости и вычислял NA.
С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального количества молекул.
Официально принятое на сегодня значение
Официально принятое на сегодня значение числа Авогадро было измерено в 2010 году. Для этого использовались две сферы, сделанные из кремния-28. Сферы были получены в Институте кристаллографии имени Лейбница и отполированы в австралийском Центре высокоточной оптики настолько гладко, что высоты выступов на их поверхности не превышали98 нм. Для их производства был использован высокочистый кремний-28, выделенный в нижегородском Институте химии высокочистых веществ РАН из высокообогащённого по кремнию-28 тетрафторида кремния, полученного в Центральном конструкторском бюро машиностроения в Санкт-Петербурге.
Располагая такими практически идеальными объектами, можно с высокой точностью подсчитать число атомов кремния в шаре и тем самым определить число Авогадро. Согласно полученным результатам, оно равно 6,02214084(18)×1023 моль−1.
Однако в январе 2011 года были опубликованы результаты новых измерений, считающиеся более точными: NA = 6,022 140 78(18)·1023 моль−1.
Чему равно число Авогадро и для чего оно вообще нужно?
Число́ Авога́дро, константа Авогадро — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12
Обозначается обычно как NA, реже как L
NA = 6,022 141 79×10в23 степени моль−1.
Закон Авогадро
На заре развития атомной теории (1811) А. Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,41383 л. Эта величина известна как молярный объем газа.
Сам Авогадро не делал оценок числа молекул в заданном объёме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в 1865 Й. Лошмидт. Из вычислений Лошмидта следовало, что для воздуха количество молекул на единицу объёма составляет 1,81 × 1018 см-3, что примерно в 15 раз меньше истинного значения. Через 8 лет Максвелл привёл гораздо более близкую к истине оценку «около 19 миллионов миллионов миллионов» молекул на кубический сантиметр, или 1,9 × 1019 см-3. В действительности в 1 см³ идеального газа при нормальных условиях содержится 2,68675·1019 молекул. Эта величина была названа числом (или постоянной) Лошмидта. С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального существования молекул.
Число Авогадро
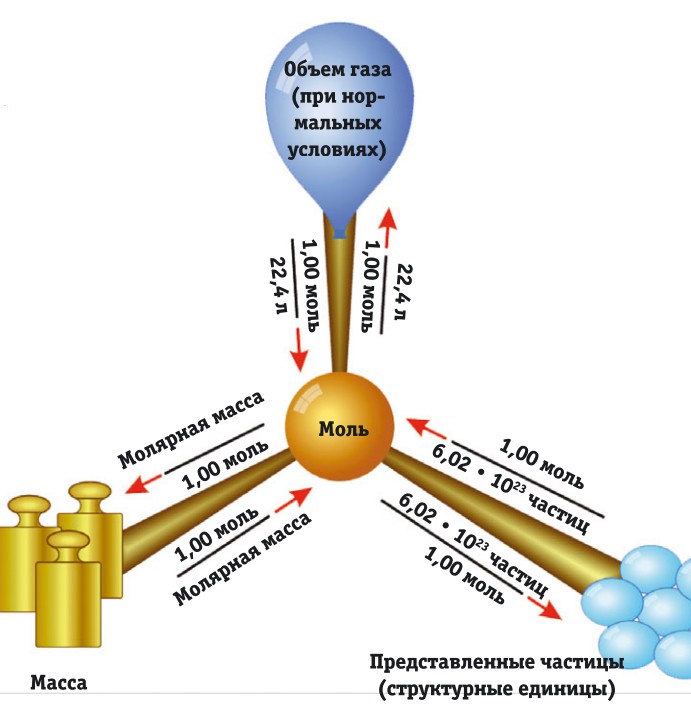
Закон Авогадро гласит, что в одинаковых объемах идеальных газов при одинаковом давлении и одинаковой температуре содержится равное число молекул. Другими словами, моль любого газа при одинаковых давлении и температуре занимает один и тот же объем. Моль — количество вещества, которое содержит столько же структурных единиц, сколько содержится в 12 г изотопа углерода 12 С. Структурные единицы — это любые частицы (атомы, молекулы, электроны, ионы и т.д.). Их количество в 1 моле вещества называется числом Авогадро. Оно позволяет определить такие величины, как заряд электрона, масса атома или молекулы и др.
Как же все это понимать? Возьмем химическую реакцию, которая происходит при горении дерева. При соединении углерода древесины с кислородом воздуха образуется двуокись углерода СО2. У одного атома углерода такая же масса, как у 12 атомов водорода, а у двух атомов кислорода — как у 32 атомов водорода. Следовательно, соотношение масс участвующих в реакции углерода и кислорода всегда будет составлять 12 : 32. Соотношение остается неизменным при любых единицах измерения: 12 г углерода всегда реагируют с 32 г кислорода, 12 ц углерода — с 32 ц кислорода и т.д. В химических реакциях главное — относительное количество атомов каждого элемента, который участвует в реакции.
Следовательно, в 12 г углерода столько же атомов, сколько в 16 г кислорода. Именно это количество атомов химики и называют молем. Если принять относительную атомную массу вещества за n (иными словами, его атом в n раз тяжелее атома водорода), то масса одного моля этого вещества будет равна n г. Моль — мера количества вещества, как пара, десяток или сотня. Сапог в паре всегда два, яиц в десятке всегда десять, и в моле вещества всегда одно и то же количество атомов, ионов или молекул.
Но как ученые к этому пришли? Ведь сосчитать атомы очень сложно. Все началось с исследований итальянского химика Амедео Авогадро. Он знал, что, когда между газами протекает химическая реакция, соотношение между объемами газов равно соотношению между количествами их молекул. Так, когда три молекулы водорода Н2 вступают в реакцию с одной молекулой азота N., то образуется две молекулы аммиака NH3, а объем участвующего в реакции водорода оказывается в три раза больше объема азота. Авогадро пришел к выводу, что количество молекул в обоих объемах находится в соотношении 3:1, т. е. в равных объемах газа содержится равное количество атомов или молекул. Это и есть известный сегодня закон Авогадро.
Чему равно число Авогадро?
Постоянная Авогадро (число Авогадро, константа Авогадро)
Постоянная Авогадро (число Авогадро, константа Авогадро).
Постоянная Авогадро (число Авогадро, константа Авогадро):
Постоянная Авогадро (число Авогадро, константа Авогадро) – физическая величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества.
Постоянная Авогадро имеет обозначение NA.
Постоянная Авогадро равна 6,022 140 76·10 23 моль −1 (точно). Ее значение точно определено в Международной системе единиц (СИ) на XXVI Генеральной конференции по мерам и весам в 2018 году и действует с 20 мая 2019 года.
Константа Авогадро названа в честь итальянского ученого Амедео Авогадро (1776-1856 гг.), который в 1811 году впервые предположил, что объем газа (при заданном давлении и температуре) пропорционален числу атомов или молекул независимо от природы газа.
А. Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое количество молекул. Впоследствии гипотеза была подтверждена многочисленными экспериментальными исследованиями и поэтому стала называться законом Авогадро. Закон Авогадро звучит так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объём, при нормальных условиях равный 22,41396954… литра. Эта величина известна как молярный объём газа.
Константа Авогадро связана с другими физическими константами и свойствами:
– с универсальной газовой постоянной R и постоянной Больцмана k, которая (универсальная газовая постоянная R) в Международной системе единиц (СИ) с 20 мая 2019 года равна 1,380 649 · 10 −23 Дж/К (точно).
– с постоянной Фарадея F и элементарным электрическим зарядом e, которая ( постоянная Фарадея ) в Международной системе единиц (СИ) с 20 мая 2019 года равна 196 485,332 123 310 0184 Кл/моль (точно).
Постоянная Авогадро
Число́ Авога́дро, константа Авогадро — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как NA, реже как L [1].
Значение числа Авогадро, рекомендованное 2006 году [2]:
Моль — количество вещества, которое содержит NA структурных элементов (т.е. столько же, сколько атомов содержится в 12 г 12 С), причем структурными элементами обычно являются атомы, молекулы, ионы и др. Масса 1 моля вещества, выраженная в граммах, численно равна его молекулярной массе. Так, 1 моль натрия имеет массу 22,9898 г и содержит примерно 6,02·10 23 атомов; 1 моль фторида кальция CaF2 имеет массу (40,08 + 2×18,998) = 78,076 г и содержит 6,02·10 23 молекул, как и 1 моль тетрахлорида углерода CCl4, масса которого равна (12,011 + 4×35,453) = 153,823 г и т. п.
Закон Авогадро
На заре развития атомной теории (1811) А. Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Позже было показано, что эта гипотеза есть необходимое следствие кинетической теории, и сейчас она известна как закон Авогадро. Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,41383 л. Эта величина известна как молярный объем газа.
Сам Авогадро не делал оценок числа молекул в заданном объеме, но понимал, что это очень большая величина. Первую попытку найти число молекул, занимающих данный объем, предпринял в 1865 Й. Лошмидт; было установлено, что в 1 см³ идеального газа при нормальных условиях содержится 2,68675·10 19 молекул. По имени этого ученого указанная величина была названа числом (или постоянной) Лошмидта. С тех пор было разработано большое число независимых методов определения числа Авогадро. Превосходное совпадение полученных значений является убедительным свидетельством реального существования молекул.
Связь между константами
См. также
Полезное
Смотреть что такое «Постоянная Авогадро» в других словарях:
постоянная Авогадро — Avogadro konstanta statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. Avogadro constant vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. константа Авогадро … Penkiakalbis aiškinamasis metrologijos terminų žodynas
постоянная Авогадро — Avogadro konstanta statusas T sritis fizika atitikmenys: angl. Avogadro’s constant; Avogadro’s number vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. постоянная Авогадро, f; число Авогадро, n pranc. constante d’Avogadro, f; nombre… … Fizikos terminų žodynas
постоянная Авогадро — Avogadro konstanta statusas T sritis Energetika apibrėžtis Apibrėžtį žr. priede. priedas( ai) MS Word formatas atitikmenys: angl. Avogadro’s constant vok. Avogadro Konstante, f; Avogadrosche Konstante, f rus. константа Авогадро, f; постоянная… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
АВОГАДРО ПОСТОЯННАЯ — (Авогадро число) (NA), число молекул или атомов в 1 моле вещества; NA=6,022?1023 моль 1. Названа по имени А. Авогадро … Современная энциклопедия
Авогадро постоянная — (Авогадро число) (NA), число молекул или атомов в 1 моле вещества; NA=6,022´1023 моль 1. Названа по имени А. Авогадро. … Иллюстрированный энциклопедический словарь
Авогадро Амедео — Авогадро (Avogadro) Амедео (9.8.1776, Турин, ‒ 9.7.1856, там же), итальянский физик и химик. Получил юридическое образование, затем изучал физику и математику. Член корреспондент (1804), ординарный академик (1819), а затем директор отделения… … Большая советская энциклопедия
Авогадро — (Avogadro) Амедео (9.8.1776, Турин, 9.7.1856, там же), итальянский физик и химик. Получил юридическое образование, затем изучал физику и математику. Член корреспондент (1804), ординарный академик (1819), а затем директор отделения физико… … Большая советская энциклопедия
АВОГАДРО ПОСТОЯННАЯ — (число Авогадро), число структурных элементов (атомов, молекул, ионов или др. ч ц) в ед. кол ва в ва (в одном моле). Названа в честь А. Авогадро, обозна чается NA. А. п. одна из фундаментальных физических констант, существенная для определения мн … Физическая энциклопедия
ПОСТОЯННАЯ — величина, имеющая неизменное значение в области её использования; (1) П. Авогадро то же, что Авогадро (см.); (2) П. Больцмана универсальная термодинамическая величина, связывающая энергию элементарной частицы с её температурой; обозначается k,… … Большая политехническая энциклопедия