истинный белок что это
Чистый белок – что подразумевается под этим показателем?
Белок содержит до 16% азота. Поэтому в лаборатории определяют содержание азота в корме, умножают его на 6,25 и полученное число показывают как сырой протеин. Сырой протеин состоит из двух групп веществ – собственно белкового вещества и других азотосодержащих веществ, или из трёх фракций сырого протеина — А, В и С.
Фракция А включает другие азотосодержащие вещества (также называемые NPN-непротеиновые вещества). Это, например, свободные аминокислоты, азотосодержащие щёлочи и кислоты, а также мочевина.
Собственно белковое вещество (фракции В1+В2+В3+С) обозначают как чистый белок. Здесь речь идет об аминокислотах. Эти различные фракции отличаются их способностью к расщеплению.
Фракция В1: не связанные клетчаткой низкомолекулярные белковые соединения, которые быстро расщепляются под воздействием энзимов.
Фракция В2: связанные в нейтрально детергентной клетчатке; расщепление посредством энзимов вариативно.
Фракция В3: связанные в кислотно детергентной клетчатке: расщепление под воздействием энзимов вариативно до медленного.
В растении чистый белок составляет от 65 до 75% (Йерох и другие, 2008) или 75-85% (Букстон и Окейли 2003) от сырого протеина. Содержание сырого протеина во втором и последующих укосах ниже, чем в первом укосе (Киршгеснер, 1960).
Защитные механизмы против внешнего влияния на расщепляемость белка у самого растения очень слабы; только ингибиторы протеиназы (тормозят действие энзимов, расщепляющих белок) могут противодействовать расщеплению протеина.
Снижения содержания чистого белка в травяном сенаже по сравнению с исходным материалом нельзя избежать, поскольку во время процесса силосования происходит расщепление протеина из-за протекающего протеолиза (Протеолиз — процесс ферментативного разложения белков, катализирующийся протеолитичес-кими ферментами, прим.пер.)
Длительность пребывания зелёной массы на поле после скашивания мало влияет на содержание чистого белка в сенаже (по Штайнхефелю и др., 2008). Автор проверял сенаж, оставляя его на поле до 5 дней и еще раз после его силосования. Во время пребывания на поле они наблюдали незначительное расщепление чистого белка. Намного более значительное расщепление происходит во время силосования (рис.1)
Рисунок 1. Влияние времени пребывания зелёной массы на поле после скашивания на содержание чистого белка в исходном материале и в силосе (Штайнхефель и др, 2008: без данных о специфике растений, стадии спелости и времени скашивания)
Силосование уменьшает содержание чистого белка
Из-за процесса брожения, при котором протекает протеолиз, значительная доля чистого белка расщепляется до небелковых соединений азота. Таким образом снижается доля нерасщепляемого в рубце протеина (UDP), в то время как доля расщепляемого в рубце сырого протеина увеличивается (рисунок 2).
Рисунок 2. Изменение фракций сырого протеина при сбраживании (по Рихардту)
Если же в процессе ферментации возникают нежелательные процессы гниения, преимущественно из-за клостридий, расщепляющих белок, в конце концов, может в сенаже быть расщеплено и трансформировано так много чистого белка, что его вообще нельзя обнаружить (рисунок 3).
В исследованиях Рихарда и Штайнхефеля (2000) доля чистого протеина в сыром протеине в клевере снизилась с 72,4% в исходном материале до 36,8% в изготовленном из него сенаже. Это означает, что содержание чистого белка снизилось приблизительно на половину из-за сравнительно обширного процесса протеолиза при силосовании. При заготовке силоса из кукурузы расщепление протеина было не настолько обширным. Здесь в исходном материале доля чистого белка составляла 80% сырого протеина, в готовом же силосе – 68,4%.
Рисунок 3. Изменение фракций протеина из-за гниения (по Рихарду)
Проведённые опыты
В рамках диссертации Гаста (2010) в 17 опытных станциях в течение 28 дней (посредством длительной инкубационной системы Рустек) исследовалось влияние 10-ти травяных силосов с низким содержанием чистого белка на ферментацию в рубце. Эти 10 низкокачественных травяных сенажей, скармливание которых привело к разным клиническим симптомам (тяжёлые расстройства пищеварения и заболевания обмена веществ с влиянием на плодовитость и молочную продуктивность до смертельных случаев), сравнили с 7-ю контрольными сенажами (доля чистого белка > 50% СП, без болезнетворных веществ). Исследуемый в данном труде показатель чистый белок состоял из фракций В и С (Штаинхоффель 2008). Эти сенажи, образцы которых направляли в различные лаборатории, показали действительно различное содержание чистого белка. Так, например, в одном контрольном сенаже лаборатория LUFA Nordwest определила содержание чистого белка на уровне 83,2% от сырого протеина. В другой лаборатории для этого же сенажа был установлен показатель 50,5%. Такое отклонение может быть обусловлено различиями в методиках анализа, а также влиянием условий хранения проб.
Белок: функции, нормы, особенности и источники
Материал проверила и прокомментировала Горбачёва Наталья Леонидовна, диабетолог, диетолог, эндокринолог, ведущий специалист сети клиник «Семейная»
Что такое белок
Белки — главный строительный материал организма. Он участвует в создании мышц, сухожилий, органов и кожи, а также нужен для производства ферментов, гормонов, нейромедиаторов и различных молекул, которые выполняют множество важных функций. Белки состоят из более мелких молекул, аминокислот, которые соединяются вместе, как бусы на нитке. Эти связанные аминокислоты образуют длинные белковые цепи, которые затем складываются в сложные формы. Некоторые аминокислоты организм производит самостоятельно, другие можно восполнить только с помощью еды.
Функции белка в организме
Рост мышц и повышение выносливости
Организму необходим протеин, ведь мышцы в основном состоят из белка. Как и большинство тканей тела, мышцы динамично разрушаются и восстанавливаются, поэтому им необходим строительный материал для роста. Чтобы мышечная масса увеличивалась, в организме должен быть положительный белковый баланс. Его также называют азотным, из-за высокого содержания этого элемента в протеине. Употребление белка помогает не только нарастить мышцы при занятиях спортом, но и предотвратить их потерю, если вы придерживаетесь строгих диет [1] [2].
Биохимические процессы
Белки — ферменты, они помогают тысячам биохимических реакций, происходящих внутри клеток организма [3]. В том числе активируют метаболизм посредством объединения с другими молекулами — субстратами. Ферменты также могут функционировать и вне клетки, например, пищеварительные — лактоза и сахароза, которые помогают переваривать сахар. От их количества зависит пищеварение, свертывание крови и энергетический баланс. Дисбаланс некоторых ферментов может привести к сбоям в работе большинства систем организма [4].
Гормональный баланс
Некоторые белки представляют собой гормоны, которые как химические посредники помогают взаимодействовать различным клеткам организма. Их производят эндокринные ткани и железы, а затем белки транспортируются по внутренним органам. Эти гормоны делят на три группы: белок и пептиды, стероиды и амины [5].
Структура тканей
Некоторые белки являются волокнами, придающими жесткость клеткам: кератин, коллаген и эластин. Они помогают формировать каркас тканей тела [6]. Кератин — строительный материал для кожи, волос и ногтей, коллаген — структурный белок костей, кожи, связок и сухожилий, а эластин позволяет тканям возвращаться в первоначальную форму после растяжений и сокращений.
Правильный pH
Белок играет жизненно важную роль в регулировании концентрации кислот и оснований в крови и других жидкостях организма [7]. Этот баланс измеряется с помощью шкалы pH от 0 до 14, где 0 — максимально кислый, 7 — нейтральный, 14 — наиболее щелочной. Протеины — один из способов регулирования этих показателей. Например, гемоглобин — тоже белок, из которого состоят эритроциты. Он связывает небольшое количество кислоты, помогая поддерживать нормальный уровень pH в крови.
Хороший иммунитет
Белки помогают формировать иммуноглобулины или антитела для борьбы с инфекцией [8] [9]. Антитела — белки в крови, которые помогают защитить организм от бактерий и вирусов. Вырабатывая их в качестве реакции на вторжение чужеродных элементов, клетки в дальнейшем лучше противостоят похожим заболеваниям.
Баланс жидкости
Альбумин и глобулин — белки крови, которые помогают сохранить баланс жидкости в организме, удерживая воду в клетках [10] [11]. При недостатке протеина могут возникать отеки, так как жидкость вытесняется в промежутки между клетками [12].
Нормализация веса
Белок важен для тех, кому необходимо нормализовать вес. Некоторые эксперименты ученых подтверждают, что увеличение количества белка в рационе ведет к повышению скорости метаболизма и снижению аппетита [13]. Протеин хорошо насыщает, в результате чего реже хочется перекусывать, снижается объем порций в основных приемах пищи [14] [15]. В одном из исследований женщины 12 недель употребляли белковую пищу в количестве 30% от дневной калорийности рациона. В среднем каждая из участниц эксперимента потеряла порядка пяти килограмм веса, сохранив здоровые пищевые привычки [16].
Норма белка в день
Если вы каждый день едите продукты животного происхождения, такие как мясо, рыбу, яйца или молочные продукты, вы, вероятно, получаете достаточно белка. Если придерживаетесь растительной диеты, получить незаменимые аминокислоты, необходимые организму, будет сложнее. Среднестатистические нормы протеина в рационе на один килограмм веса:
В некоторых случаях требуется больше белка, например, в периоды болезни, интенсивных занятий спортом, а также при беременности и кормлении грудью [17] [18]. Данные о точном количестве вещества разнятся, поэтому правильно будет проконсультироваться с лечащим врачом, который подберет индивидуальный рацион, исходя из особенностей организма. Так, авторы одного исследования утверждают, что беременным женщинам в день необходимы 1,2–1,52 г протеина на один кг веса [19]. Другие врачи рекомендуют потреблять дополнительно 1,1г белка на кг веса [20]. Суточная норма белка во время грудного вскармливания составляет 1,3 г на килограмм в день плюс 25 дополнительных граммов [21].
Активным людям требуется больше белка, чем тем, кто ведет малоподвижный образ жизни. Спортсменам, предпочитающим тренировки на выносливость, необходимо около 1,2–1,4 г на каждый кг веса [22] [23]. Достаточное количество протеина необходимо для предотвращения развития заболеваний, таких как остеопороз. Пожилым людям, а также тем, кто восстанавливается после травмы или операции, требуется до 1–1,3 г на один кг массы тела [24] [25].
Сколько белка в яйцах, курице и твороге
Эти продукты врачи и диетологи чаще всего упоминают как отличные источники протеина:
Яйца. Содержат 6-7 г белка на штуку среднего размера. Содержатся они именно в белковой части яйца. Поэтому в фитнес-меню часто присутствуют блюда без желтка, но на самом деле, при сбалансированном рационе нет смысла от них отказываться.
Курица. Если необходимо добавить белка в рацион, выбирайте куриную грудку — в ней больше волокон и меньше жира. На 100 г продукта — 27% белка. Оптимальный ингредиент для повышения уровня белка в организме, если вы не придерживаетесь растительной диеты.
Творог. В 200-граммовой пачке творога содержится 35 г белка, что соответствует почти трети среднестатистической дневной нормы. Отдавайте предпочтение творогу средней жирности, так как обезжиренного усваивается меньше необходимым микроэлементов.
Продукты, богатые белком
В первую очередь, протеин попадает в организм из животных продуктов. Средние показатели белка на 100 г продукта:
Вегетарианцам и веганам стоит позаботиться о наличии растительного белка в рационе. Это могут быть бобовые, крупы, соевые и цельнозерновые продукты:
Норма белка в моче и крови
Лучший способ проверить, хватает ли организму белка, — сдать анализы, например биохимический анализ крови. В норме концентрация белка в крови взрослого человека должна составлять 62–86 г/л, а у детей — от 45 до 80 г/л. Снижение этих показателей возникает в результате ряда заболеваний, в том числе первичных иммунодефицитов, нарушениях обмена веществ, дисфункциях желудочно-кишечного тракта, а также дефицита протеина в рационе.
Превышение нормы встречается редко, но оно может указывать на хронические тяжелые инфекции (такие как туберкулез), ускоренный распад эритроцитов, системные опухоли или обезвоживание организма.
С-реактивный белок — фракция протеинов плазмы, которая повышается при наличии в организме воспалительного процесса. Синтезируется в ответ на попадание в кровь токсинов патологических микроорганизмов и обезвреживает их путем их связывания, а также запускает иммунные реакции. С-реактивный белок в норме отсутствует в крови (либо его показатели не превышают 0,4 мг/л). Большие значения указывают на развитие патологий: инфекционных и вирусных заболеваний, панкреатита, пиелонефрита, гепатита, язвенного колита и онкологии.
Помимо крови, белок учитывают в анализе мочи. Небольшое его количество встречается и у здоровых людей, в норме — до 140 мг/л (до 0,140 г/л). При активной физической нагрузке показатели не должны превышать 250 мг/сутки (0,250 г/л). Для того, что точнее узнать потери белка с мочой, необходимо проводить исследование его концентрации в суточных анализах. Их назначают при заболеваниях мочевыделительной системы и почек, инфекциях, а также для контроля осложнений, в том числе при приеме препаратов, оказывающих нефротоксическое действие — поражение почек.
Переизбыток белка
Высокое потребление белка может нанести вред людям с заболеваниями почек [26]. Двумя основными факторами риска почечной недостаточности являются высокое кровяное давление (гипертония) и диабет. И то, и другое провоцируется переизбытком белка [27] [28]. Точное количество необходимого протеина варьируется в зависимости от возраста, состояния здоровья и образа жизни. Исследование с участием здоровых мужчин, занимающихся силовыми тренировками, показало, что ежедневное употребление 3 г белка на кг массы тела в течение года не имело никаких неблагоприятных последствий для здоровья [29]. Даже 4,4 г на кг веса в течение двух месяцев не вызывало никаких побочных эффектов [30].
Нет никаких доказательств того, что потребление белка в разумных количествах причиняет вред здоровым людям. Напротив, существует множество доказанных преимуществ. Однако, если у вас заболевание почек, следует следовать советам врача и ограничить потребление протеинов.
Богатое белками, но бедное жирами и углеводами питание — нагрузка на почки и печень. Переизбыток белка на фоне нехватки других необходимых организму веществ выражается в проблемах с пищеварением, неприятном запахе изо рта и постоянной жажде.
Недостаток белка
Помимо показателей медицинских анализов есть и другие признаки недостатка протеина, которые вы можете заметить перед походом к врачу.
Постоянный голод
Белки насыщают и заряжают энергией надолго, но в качестве перекуса многие из нас используют не белковые продукты, а содержащие углеводы: бананы, печенье, конфеты, выпечку и бутерброды. Еда, богатая углеводами, приводит к быстрому подъему уровня сахара (и мы чувствуем себя сытыми) и такому же быстрому падению (через полчаса мы снова голодны). Этот же эффект вызывает тягу к сладкому: организму не хватает сил, а конфета — самый быстрый способ их получить. Правда, ненадолго.
Слабые волосы и ногти
Ногти и волосы — это тоже белок, а точнее, кератин. Для их здоровья регулярное потребление белковой пищи абсолютно необходимо, иначе организму неоткуда будет брать строительный материал. При дефиците белка волосы становятся тонкими, слабыми и тусклыми, плохо растут и секутся, а ногти начинают ломаться и расслаиваться.
Медленное заживление ран
Если даже маленькая царапина заживает дольше недели, это тоже может быть признаком недостатка белка. Он входит в состав клеток мышечной ткани, кожи и крови, поэтому, если макроэлемента не хватает, на ремонт повреждений у организма уходит гораздо больше времени.
Частые инфекционные болезни
По мнению доктора Алиссы Рамси из американской Академии питания и диетологии, белок также необходим для построения клеток иммунной системы — если вы едите мало белковых продуктов, со временем защита организма может ослабеть.
Без белка замедляется выработка интерферона и лизоцима, «защитников», отбивающих атаки патогенов. Иммунитет перестает справляться с бактериями и вирусами, и мы болеем чаще. Причем любыми инфекционными заболеваниями: у людей на низкобелковой диете часто диагностируют инфекции.
Отеки
Дефицит белка приводит к нарушению водно-солевого баланса, из-за чего жидкость скапливается в тканях. Результат — мешки под глазами и опухшее по утрам лицо, отеки лодыжек и стоп, чувство тяжести в ногах, которое появляется уже в середине дня, даже если вы носите удобную обувь.
Снижение веса
У нашего организма свои приоритеты. Если белка не хватает, то все поступающие протеины направляются туда, где они жизненно необходимы, то есть к внутренним органам. Мышцам при этом почти ничего не достается, и они начинают уменьшаться в объеме. Правда, снижение мышечной массы при белковой недостаточности заметить трудно — за счет отеков вес может оставаться относительно стабильным или снижаться очень медленно. Зато вы точно заметите другие признаки постепенной атрофии мышечной ткани — слабость и быструю утомляемость. Люди, желающие скорректировать вес, часто отказываются от жиров или белка, но это ошибка. Важно соблюдать баланс: основу правильной диеты составляют мясо, рыба (или продукты с высоким содержанием белка растительного происхождения), крупы и овощи.
Плохое настроение
Белок, помимо всего прочего, важен для синтеза нейромедиатора серотонина. Именно он отвечает за хорошее настроение и стрессоустойчивость. Недостаток серотонина приводит не только к хандре, плаксивости и мрачным мыслям, но и к бессоннице, повышенной тревожности, нервозности и склонности взрываться по пустякам.
Комментарии эксперта
Горбачёва Наталья Леонидовна, диабетолог, диетолог, эндокринолог, ведущий специалист сети клиник «Семейная»
«Правильный белковый обмен веществ — баланс между распадом и синтезом белков. Организму должно хватать аминокислот для построения новых соединений. Степень усвоения белка зависит от его происхождения и способа термической обработки. Элемент не способен накапливаться в организме, его излишки выводятся с помощью почек. Поэтому чрезмерное потребление белка негативно сказывается на их состоянии
Причинами нарушений белкового обмена могут стать наследственные заболевания: подагра, а также тяжелые состояния, такие как онкопатологии, следствие радиационного облучения и прочее. Но в большинстве случаев у взрослого человека симптомы нарушения биосинтеза белков говорят о несбалансированном рационе питания.
Недостаток белков — актуальная проблема. Одних она настигает при избавлении от лишнего веса, других — при вегетарианстве, а третьих — из-за заболеваний пищеварительной и эндокринной систем. Дефицит белков может не проявляться клинически, но последствия недостатка протеина довольно печальны:
Если биосинтез белков нарушен на этапе построения, человек может страдать от белкового отравления. Характерными признаками интоксикации являются поражение печени и почек, нарушения работы ЖКТ. Переизбыток белка влияет на центральную нервную систему вплоть до серьезных поражений при врожденных нарушениях обмена веществ. При ухудшении самочувствия необходимо сдать анализы и получить рекомендации специалиста. »
Истинный белок что это
Белковая недостаточность представляет собой болезненное состояние организма, связанное с недостаточным поступлением и усвоением белка либо с его усиленным распадом. Истинный дефицит поступления белков с пищей может развиваться у лиц, длительное время недоедающих, придерживающихся так называемых монодиет, или у вегетарианцев. Вторичный дефицит белка, связанный с его усиленным распадом, может сопровождать целый ряд заболеваний, например тяжелые формы инфекционных заболеваний, ожоги, патологии почек, наследственные нарушения обмена веществ. Белки являются основным строительным материалом организма, поэтому даже легкие формы белковой недостаточности, внешне протекающие бессимптомно, влияют на способность противостоять инфекции или на скорость заживления ран, замедляют рост ногтей и волос, вызывают сухость кожи. Тяжелая белковая недостаточность может нарушить нормальную работу всех органов и систем. Особенно опасен дефицит белка в детском возрасте, так как он способен повлиять на развитие умственных способностей, формирование мышц, замедлить рост ребенка.
Своевременное выявление белковой недостаточности и установление ее причины крайне важно, так как позволяет избежать опасных для жизни осложнений.
Дефицит белка, белковая дистрофия, белково-энергетическая недостаточность.
Легкие формы белковой недостаточности чаще всего протекают бессимптомно. Исключение могут составлять наследственно обусловленные дефициты отдельных аминокислот (структурных компонентов молекулы белка), характерные признаки которых наблюдаются в раннем детском возрасте.
Внешние проявления дефицита белка:
Проявления со стороны нервной системы:
Проявления со стороны костно-мышечной системы:
Со стороны органов пищеварения:
Кто в группе риска?
Общая информация о заболевании
Белки относятся к числу основных питательных веществ, выполняющих в организме следующие функции.
Реализация этих функций происходит за счет белкового обмена – постоянно протекающих процессов образования (синтеза) и распада белка.
Основные причины белковой недостаточности:
В зависимости от степени выраженности недостаток белка может приводить к:
Белковая недостаточность в первую очередь может быть заподозрена у пациентов с дефицитом массы тела, а также у лиц с симптомами заболеваний, для которых характерен дефицит белков. Для подтверждения диагноза проводится комплекс исследований.
Дополнительные (инструментальные) методы исследования
Объем диагностических исследований зависит от предполагаемой причины белковой недостаточности и должен определяться лечащим врачом. К числу основных методов диагностики относятся:
Лечение белковой недостаточности направлено на восполнение объема белка и нормализацию белкового обмена. Одновременно лечится основное заболевание.
Оно может включать в себя следующие пункты.
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
1.1. Состав коровьего молока
В коровьем молоке (далее по тексту — молоко) различают истинные компоненты, синтезируемые в процессе обмена веществ при секреции молока, и неистинные (посторонние, чужеродные) — антибиотики, пестициды, тяжелые металлы, радиоизотопы и т. п., попадающие из кормов и других источников. Количество вторых небезопасно для здоровья населения и регламентируется соответствующими документами.
Показатели химического состава — среднее содержание (в г/100 г коровьего молока) — приведены ниже:
| вода | 87,3 |
| сухие вещества | 12,7 |
| в том числе: | |
| белки | 3,2 |
| в том числе: | |
| казеин (αs1-, αs2-, β-, χ-фракции) | 2,6 |
| сывороточные белки | 0,6 |
| в том числе: | |
| β-лактоглобулин | 0,30 |
| α-лактальбумин | 0,12 |
| альбумин сыворотки крови | 0,04 |
| иммуноглобулины | 0,05 |
| лактоферрин | Следы |
| белок оболочек жировых шариков | 0,02 |
| липиды | 3,6 |
| в том числе | |
| молочный жир | 3,55 |
| фосфолипиды (лецитин, кефалин, сфингомиелин) | 0,03 |
| стерины (холестерин, ланостерин, 7-дегидрохолестерин) | 0,01 |
| углеводы | 4,8 |
| в том числе: | |
| лактоза | 4,55 |
| глюкоза, мг | 0,05 |
| галактоза, мг | 0,08 |
| олигосахариды | Следы |
| минеральные вещества | 0,7 |
| в том числе: | |
| макроэлементы, мг: | |
| кальций | 120 |
| калий | 146 |
| натрий | 50 |
| магний | 14 |
| фосфор | 95 |
| сера | 29 |
| хлориды | 110 |
| микроэлементы, мкг: | |
| Fe | 67 |
| Cu | 12 |
| Se | 2 |
| Zn | 400 |
| F | 20 |
| J | 4 |
| Mn | 6 |
| Mo | 5 |
| Co | 0,8 |
| Sn | 13 |
| Al | 50 |
| Sr | 17 |
| Cr | 2 |
| витамины: | |
| водорастворимые: | |
| тиамин (В1), мг | 0,04 |
| рибофлавин (В2), мг | 0,15 |
| пантотеновая кислота (В3), мг | 0,38 |
| ниацин (РР), мг | 0,10 |
| пиридоксин (В6), мг | 0,05 |
| биотин (Н), мкг | 3,20 |
| фолацин (В9), мкг | 5,00 |
| цианокобаламин (В12), мкг | 0,40 |
| аскорбиновая кислота (С), мг | 1,50 |
| жирорастворимые: | |
| А, мг | 0,03 |
| D, мкг | 0,05 |
| E, мг | 0,09 |
| F, мг | 0,21 |
| K, мг | 0,03 |
| витаминоподобные соединения, мг: | |
| оротовая кислота | 10,00 |
| n-аминобензойная кислота | 0,01 |
| холин и др. | 23,60 |
| пигменты: | |
| β-каротин, мг | 0,02 |
| ксантофиллы | Следы |
а также: ферменты, в том числе дегидрогеназы, каталаза, плазмин. ксантиноксидаза, липаза, амилаза, пероксидаза, фосфатаза, лизоцим и др.; гормоны: пролактии, окситоцин, соматотропин, кортикостероиды, андрогены, эстрогены, прогестерон, тироксин, протогландины и др.; посторонние химические вещества: антибиотики, токсичные элементы, бактериальные токсины, пестициды, радионуклиды (90Sr, 137Cs, 131J, диоксины, детергенты, микотоксины и др.; газы, в том числе СО2, О2, Н2.
Следует отметить, что вследствие биологического происхождения молока, а также с учетом развития средств измерения, его химический состав, приводимый в технической литературе различными авторами, может отличаться по отдельным компонентам от приведенных значений.
Как видно из этих данных, наибольший удельный вес (более 85%) в молоке занимает вода, а на остальные компоненты (белки, липиды, углеводы и др.), входящие в состав сухих веществ или сухого остатка, приходится около 13%.
Содержание отдельных компонентов в молоке непостоянно. Оно изменяется в течение лактации и зависит от породы, возраста животных, рационов кормления, болезней, условий содержания, районов разведения скота, климатических условий, времени года и т. п.
Вода. Вода молока является диспергирующей средой и растворителем органических и неорганических веществ. Большая часть содержащейся в молоке воды (83. 87%) находится в свободном состоянии, а меньшая часть (3. 3,5%) — в связанной форме.
Свободная вода — это вода, являющаяся растворителем органических и неорганических соединений молока (лактозы, минеральных веществ, кислот, ароматических веществ и т. п.). Как растворитель, свободная вода участвует во всех биохимических процессах, протекающих в молоке при выработке молочных продуктов. Она легко удаляется при сгущении, сушке и переводится в состояние льда при замораживании молока.
Связанная, или адсорбционная вода — это вода, удерживаемая молекулярными силами гидрофильных групп молекул белков и других полимеров. По форме связи с компонентами (продуктом) вода, согласно классификации П. А. Ребиндера, делится на три группы: вода химической связи; вода физико-химической связи; вода физико-механической связи.
Наиболее прочной является химическая связь воды в химических соединениях и кристаллогидратах (органически связанная вода). Эта связь возникает при строго определенных стехиометрических соотношениях и с трудом разрушается при надевании. В молочных продуктах органически связанная вода представлена водой кристаллогидратов молочного сахара (С12Н22О11 • Н20). Ее можно удалить при нагревании гидратной формы сахара до температуры 125. 130 °С.
Физико-химическая связь воды характеризуется средней прочностью, она образуется в результате притяжения диполей воды полярными группами молекул белков (а также фосфолипидов, олигосахаридов и др.). При адсорбировании воды диполи располагаются несколькими слоями вокруг гидрофильных центров молекулы белка, образуя так называемую гидратную (водную) оболочку. От интенсивности и прочности гидратной оболочки зависит стабильность мицелл казеина и жировых шариков.
Первый слой оболочки, представляющий собой ориентированные неподвижные молекулы воды, связан с белком наиболее прочно, последующие слои — с меньшей энергией связи.
Воду первого слоя называют влагой мономолекулярной адсорбции; воду остальных слоев — влагой полимолекулярной адсорбции, свойства которой существенно отличаются от свойств свободной воды
Связанная вода по своим свойствам значительно отличается от свободной воды [3, 7, 8]. Она не замерзает при низких температурах (-40°С и ниже), не растворяет электролиты, имеет плотность, вдвое превышающую плотность свободной воды, не удаляется из продукта при сушке и т. п. Связанная вода в отличие от свободной недоступна микроорганизмам. Поэтому для подавления развития микрофлоры (а также химических реакций) в пищевых продуктах свободную воду полностью удаляют или переводят в связанную, добавляя влагосвязывающие компоненты (сахар, соли, многоатомные спирты, белки и т. п.). При этом понижается величина так называемой «активности воды». Под активностью воды (aω) понимают отношение давления паров воды над данным продуктом к давлению паров над чистой водой при одной и той же температуре.
Вода физико-механической связи по свойствам ближе к свойствам свободной воды. Она механически захватывается и удерживается ячейками структуры (и капиллярами) продукта. В сыре — это влага смачивания и влага макропор.
Сухие вещества. В состав сухих веществ молока входят белки, липиды, углеводы, минеральные вещества, ферменты, витамины и др.
Массовая доля сухих веществ молоке составляет 11. 14% и зависит от его состава. Массовая доля сухого обезжиренного остатка (COMO) колеблется от 8 до 9%. Сухой остаток (особенно количество в нем белка) является наиболее ценной частью молока, максимальное сохранение которого необходимо при производстве сыра.
Белки. Общее содержание белков в молоке колеблется от 2,8 до 3,6%. Белки молока разнообразны по строению, физико-химическим свойствам и биологическим функциям. Они необходимы для обеспечения нормального развития и роста теленка, а также играют значительную роль в питании людей.
Классификация и биологические функции белков. Основными группами белков молока являются казеины (75. 85% общего количества белков) и сывороточные белки — глобулины, альбумины (15. 22%).
Казеин и сывороточные белки не являются гомогенными, а состоят из смеси различных белков.
Классификация белков молока представлена в табл. 1.1.
Таблица 1.1 Классификация и основные показатели белков молока
25 000
19 000
24 000
18 000
14 000
Примечание. Классификация белков составлена на основе номенклатурной схемы, разработанной Комитетом по номенклатуре и методологии молочных белков Американской научной ассоциации молочной промышленности.
К белкам следует также отнести ферменты, некоторые гормоны (пролактин и т. п.) и белки оболочек жировых шариков.
Биологические функции почти всех белков молока определены. Известно, что казеины являются собственно пищевыми белками. Они максимально расщепляются пищеварительными протеиназами в нативном состоянии, в то время как обычно глобулярные белки приобретают эту способность только после денатурации (М. П. Черников). Казеины обладают свойством свертываться в желудке новорожденного с образованием сгустков высокой степени дисперсности. Кроме того, они являются источником кальция, фосфора и магния, а также целого ряда физиологически активных пептидов (так, при частичном гидролизе χ-казеина под действием химозина в желудке освобождается гликомакропептиды, регулирующие процесс пищеварения — уровень желудочной секреции; физиологическая активность, по-видимому, присуща и растворимым фосфопептидам, образующимся при гидролизе β-казеина).
Не менее важными биологическими функциями обладают сывороточные белки. Так, иммуноглобулины выполняют защитную функцию, являясь носителями пассивного иммунитета, лактоферрин и другой белок — лизоцим, относящийся к ферментам молока, обладают антибактериальными свойствами. Лактоферрин и β-лактоглобулин выполняют транспортную роль — переносят в кишечник новорожденного железо, витамины и другие важные нутриенты. Сывороточный белок α-лактальбумин имеет специфическую регуляторную функцию: он необходим для процесса синтеза лактозы. В-лактоглобулин является ингибитором фермента плазмина.
Аминокислотный состав белков. Белки молока содержат почти все аминокислоты, обычно встречающиеся в белках (табл. 1.2).
В состав белков молока входят как циклические, так и ациклические аминокислоты — нейтральные, кислые и основные, причем преобладают кислые. Количество отдельных групп аминокислот в белках, определяемое породой, индивидуальными особенностями животных, стадией лактации, сезоном и другими факторами, обусловливает их физико-химические свойства. Белки молока по сравнению с глобулярными белками других пищевых продуктов содержат сравнительно много лейцина, изолейцина, лизина, глутаминовой кислоты, а казеин — также серина и пролина (но мало цистеина), сывороточные белки характеризуются высоким содержанием серосодержащих аминокислот.
По содержанию и соотношению незаменимых аминокислот белки молока, особенно сывороточные, относятся к биологически полноценным белкам.
Структура баков. В настоящее время известны первичные структуры всех фракций казеина, α-лактальбумина, β-лактоглобулина и трех компонентов бывших протеозопептонов. Получены некоторые данные о вторичной, третичной и четверичной структурах основных белков молока и предложены модели структуры мицелл казеина.
Для наглядности на рис. 1.1 представлена схема первичной структуры χ-казеина.
Три компонента протезопептонов (5, 8 «быстрый» и 8 «медленный») также являются фрагментами β-казсина и содержат соответственно аминокислотные остатки 1. 28; 1. 105; 1. 107 и др.
Аминокислотный состав белков молока
| Аминокислоты | Сокращенные обозначения | Содержание в белках молока, в% | |||||||
| В казеине | В β-лакто-глобулине | В α-лакталь-бумине | В иммуно-глобулине G | В альбумине сыворотки крови | |||||
| В целом | В том числе по фракциям | ||||||||
| α-казеин | χ-казеин | β-казеин | |||||||
| Незаменимые: | |||||||||
| Валин | Вал | 7,2 | 5,60 | 5,10 | 10,20 | 5,8 | 4,7 | 9,6 | 12,3 |
| Изолейцин | Иле | 6,1 | 6,00 | 6,14 | 5,50 | 6,1 | 6,8 | 3,1 | 2,6 |
| Лейцин | Лей | 9,2 | 9,40 | 6,08 | 11,6 | 15,6 | 11,5 | 9,1 | 12,3 |
| Лизин | Лиз | 8,2 | 8,70 | 5,76 | 6,50 | 11,4 | 11,5 | 9,1 | 12,3 |
| Метионин | Мет | 2,8 | 3,00 | 1,00 | 3,40 | 3,2 | 1,0 | 1,1 | 0,8 |
| Треонин | Тре | 4,9 | 2,50 | 6,64 | 5,10 | 5,8 | 5,5 | 10,1 | 5,8 |
| Триптофан | Три | 1,7 | 2,00 | 1,05 | 0,83 | 1,9 | 7,0 | 2,7 | 0,7 |
| Фемилаланин | Фен | 5,0 | 5,60 | 4,07 | 5,80 | 3,5 | 4,5 | 3,8 | 6,6 |
| Заменимые: | |||||||||
| Аланин | Ала | 3,00 | 3,40 | 5,41 | 1,70 | 7,4 | 2,1 | — | 98 |
| Аргинин | Арг | 4,10 | 4,40 | 4,00 | 3,40 | 2,9 | 1,2 | 3,5 | 122 |
| Аспарагиновая кислота | Асп | 7,10 | 8,45 | 7,30 | 4,90 | 11,4 | 18,7 | 9,4 | 218 |
| Гистидин | Гис | 3,10 | 3,30 | 1,67 | 3,10 | 1,6 | 2,9 | 2,1 | 90 |
| Глицин | Гли | 2,70 | 3,00 | 1,31 | 2,40 | 1,4 | 3,2 | — | 47 |
| Глутаминовая кислота | Глу | 22,40 | 23,60 | 17,35 | 23,20 | 19,5 | 12,9 | 12,3 | 717 |
| Пролин | Про | 22,30 | 8,20 | 8,78 | 16,00 | 4,1 | 1,5 | — | 302 |
| Серин | Сер | 6,30 | 7,40 | 7,40 | 3,20 | 3,8 | 5,4 | — | 186 |
| Тирозин | Тир | 6,30 | 7,40 | 7,40 | 3,20 | 3,8 | 5,4 | — | 184 |
| Цистеин + цистин | Цис | 0,34 | — | 1,40 | — | 3,4 | 6,4 | 3,0 | 6 |
Состояние казеина в молоке. Основная часть казеина (95%) в молоке содержится в виде сравнительно крупных частиц — мицелл и лишь незначительная часть (около 5%) — в виде мономеров, полимеров фракции казеина и субмицелл.
Все фракции казеина являются фосфопротеидами (фосфатные группы присоединяются к остаткам серила цепи), а χ-казеин принадлежит к фосфогликопротеидам. Основные фракции казеина гидрофобны, имеют неравномерное распределение вдоль полипептидных цепей полярных и неполярных аминокислот.
αs1-, αs2-, β-Фракции чувствительны к ионам кальция, а также самоассоциируют с помощью гидрофобных и электростатических взаимодействий. Чувствительность фракций казеина к кальцию зависит от количества фосфатных остатков в полипептидных цепях, к которым он присоединяется, образуя кальциевые мостики. Их в αs2-казеине 10. 13 остатков, αs1-казеине — 8. 9, β-казеине — 5 остатков, χ-Казеин содержит только один фосфатный остаток, поэтому практически не присоединяет ионы кальция, то есть не теряет растворимость в их присутствии. При ассоциации с αs- и β-казеином χ-казеин образует стабильные мицеллы и таким образом защищает частицы от осаждения ионами кальция.
χ-Казеин содержит чувствительную к сычужному ферменту (химозину) пептидную связь, поэтому коагулирует при внесении последнего в молоко (подробнее см. часть II).
Минеральный состав (в %) мицелл казеина коровьего молока следующий:
| Кальций (органический и неорганический) | 2,7. 2.9 |
| Магний | 0,1. 0,2 |
| Калий | 0,2…0,3 |
| Натрий | 0,1 |
| Фосфор | 2,9. 4,3 |
| Цитраты | 0.4…0,5 |
Частицы казеина различны по величине, их диаметр колеблется от 50 до 300 нм. Средний диаметр мицеллы равен 100. 150 нм.
Предложено много моделей мицеллы казеина. Однако ее структура окончательно не установлена. Сейчас преобладают модели субмицеллярного строения мицелл (модели Мора, Шмидта, Слаттери и др.). Авторы предполагают, что казеиновые мицеллы состоят из плотно упакованных субмицелл размером 10. 20 нм.
Состав мицелл казеина разного диаметра неодинаков. Содержание минеральных веществ (КФК) и αs-казеина снижается с уменьшением размера частиц, а количество χ-казеина повышается. Мицеллы казеина имеют рыхлую структуру, так как связывают значительное количество воды; степень гидратации составляет 3,7 г Н20 на 1 г белка.
Способность казеина связывать воду имеет большое практическое значение. От гидрофильных свойств казеина зависит устойчивость частиц белка в сыром, пастеризованном и стерилизованном молоке. В процессе высокотемпературной тепловой обработки молока происходит взаимодействие денатурированного β-лактоглобулина с казеином, в результате чего гидрофильные свойства казеина усиливаются. От интенсивности этого взаимодействия зависят структурно-механические свойства (прочность, способность отделять сыворотку) кислотного и кислотно-сычужного сгустков, образующихся при выработке сыра. Гидрофильные свойства казеина и продуктов его распада также определяют водосвязывающую и влагоудерживающую способность сырной массы при созревании сыра, то есть консистенцию готового продукта.
Состав и свойства сывороточных белков. После осаждения казеина из обезжиренного молока кислотой в сыворотке остается группа азотистых соединений (15. 22% всех белков), называемых «сывороточными белками». Основными из них являются β-лактоглобулин, α-лактальбумин, альбумин сыворотки крови, иммуноглобулины, компоненты протеозопептонной фракции и лактоферрин. Кроме них в сыворотке содержится небелковый азот.
Сывороточные белки являются глобулярными белками и представляют собой гидрофильные коллоиды. В нативном состоянии вследствие прочной гидратной оболочки и высокой степени дисперсности они образуют относительно устойчивые коллоидные растворы. Этим свойством объясняется их способность выполнять роль защитных коллоидов.
Сывороточные белки по содержанию дефицитных незаменимых аминокислот (лизина, триптофана, метионина, треонина) и цистеина (см. табл. 1.2) являются наиболее биологически ценной частью белков молока, поэтому их использование для пищевых цепей имеет большое практическое значение. В настоящее время для их выделения в нативном состоянии из сыворотки и обезжиренного молока применяются мембранные методы обработки — ультра-, гипер- и нанофильтрацию.
α-Лактоглобулин. На долю β-лактоглобулина приходится около половины сывороточных белков (или 7. 12% общего количества белков молока). В молоке белок находится в виде димера, состоящего из двух полипептидных цепей с молекулярной массой около 18 000 каждая (размер частиц равен 25. 50 нм). При нагревании молока до температуры выше 30°С β-лактоглобулин распадается на мономеры, которые при дальнейшем нагревании агрегируют за счет образования дисульфидных связей.
Денатурированный в процессе пастеризации β-лактоглобулин образует комплексы с χ-казеином мицелл казеина и осаждается вместе с ними при кислотной и сычужной коагуляции казеина. Образование комплекса β-лактоглобулин-χ-казеин значительно ухудшает атаку χ-казеина сычужным ферментом.
α-Лактальбумин. В сывороточных белках α-лактальбумин занимает второе место после β-лактоглобулина и является гетерогенным белком. Его содержание составляет 2. 5% от общего количества белков молока. Он содержит главный компонент, имеющий два генетических варианта (молекулярная масса около 14 000), а также второстепенные компоненты, некоторые из которых являются гликопротеидами. Установлено, что α-лактальбумин является металлопротеидом — способен связывать ионы кальция.
В молоке α-лактальбумин тонкодиспергирован (размер частиц 15. 20 нм). Он не коагулирует в изоэлектрической точке (при рН 4,2. 4,5) в силу своей большой гидратированности, не свертывается под действием сычужного фермента, термостабилен. Повышенная устойчивость α-лактальбумина к нагреванию обусловлена его свойством к ренатурации, для осуществления которой необходимо присоединение к белковой молекуле кальция.
Иммуноглобулины. В обычном молоке иммуноглобулинов содержится очень мало (1,9. 3,3% общего количества белков). В молозиве они составляют основную массу (до 90%) сывороточных белков. Иммуноглобулины объединяют группу высокомолекулярных белков (гликопротеидов), выполняющих функцию антител[2]. Содержание всех компонентов бывшей протеозо-пептонной фракции увеличивается в процессе длительного хранения молока при температуре 2. 4°С.
Лактоферрин. Это красный железосвязываюший белок, по своим свойствам похожий на трансферрин крови, но отличающийся последовательностью аминокислот в цепи. Лактоферрин является гликопротеидом с молекулярной массой около 76 500, обладает бактериостатическим действием по отношению к Е.coli. В коровьем молоке содержится в малых количествах, однако, его количество в молоке увеличивается при маститей перед окончанием лактации. Молозиво содержит около 1 мг/мл лактоферрина.
Помимо белкового азота в сыворотке содержится небелковый (остаточный) азот. Содержание небелковых азотистых веществ, оставшихся в растворе после осаждения всех белков молока, составляет 5. 6% общего азота в молоке. Их роль пока мало изучена. Количество небелкового азота в молоке зависит от породы животного, условий кормления и стадии лактации. Эти вещества представляют собой пептиды, свободные аминокислоты, а также различные низкомолекулярные азотистые соединения, попадающие в молоко непосредственно из крови животного (мочевина, мочевая кислота, креатин и др.).
Из всех небелковых азотистых соединений наибольшее значение для молочной промышленности имеют свободные аминокислоты, являющиеся одним из основных источников азотистого питания молочнокислых бактерий.
Липиды. Липиды молока в основном состоят из триацилглицеринов (молочного жира) и жироподобных веществ (фосфолипидов, стеринов и пр.), входящих в состав оболочек (рис. 1.2). Молочный жир является энергетически ценным компонентом молока, кроме того, он обусловливает определенный вкус и консистенцию молочных продуктов (сыра).
Молочный жир. Содержание жира в молоке (молочного жира) колеблется от 2,7 до 4,5%. Основной компонент жира молока — ацилглицерины (глицериды), составляющие но массе около 98,5%. Содержание сопутствующих жирам веществ (омыляемых и неомыляемых липидов или природных примесей) в нем невелико и обычно равно менее 2%. Они входят в состав липопротеидных оболочек шариков жира и частично связаны с белками молочной плазмы.
Глицеридный и жирнокислотный состав. Триацилглицерины (триглицериды) молочного жира составляют около 97% и представляют собой сложную смесь сложных эфиров трехатомного спирта глицерина и жирных кислот, построенных по следующему типу:
В 1- и 3-положениях триглицеридов жира молока преобладают стеариновая, олеиновая и низкомолекулярные жирные кислоты С4. С10, в 2-положении — лауриновая, миристиновая, пальмитиновая, пальмитолеиновая.
Наряду с триацилглицеринами жир молока содержит незначительное количество продуктов неполного синтеза или гидролиза липидов — ди- и моноацилглицеринов (1,2. 2,6% всех ацилглицеринов) и свободных жирных кислот. Количество свободных жирных кислот увеличивается при хранении молока.
Как известно, свойства жиров определяются составом и характером распределения жирных кислот в молекулах триглицеридов.
В триглицеридах молочного жира обнаружено 140 жирных кислот с числом атомов углерода от С4 до C26: насыщенные с четным и нечетным числом атомов углерода, моно- и полиненасыщенные (цис- и транс-изомеры), изо-, антеизо- и многократно разветвленные насыщенные кислоты, гидрокси- и кетокислоты. На основе анализа данных отечественных и зарубежных исследователей (М. Ф. Курковой, А. П. Копниной, С. С. Гуляева-Зайцева, А. П. Белоусова, А. Тепель и др.) авторами подготовлена справочная таблица (табл. 1.3) по жирнокислотному составу молочного жира. При этом помимо распространенных (тривиальных) названий жирных кислот приведены наименования по Женевской номенклатуре (систематические).
Как видно из этой таблицы, состав жирных кислот молочного жира непостоянен и содержание отдельных жирных кислот в нем может меняться. Он зависит от кормовых рационов, стадии лактации, сезона, географической зоны, породы животных и других факторов.
Жирнокислотный состав молочного жира
Низкомолекулярные жирные кислоты обусловливают запах и вкус молочного жира. Жирные кислоты, содержащие более 12 атомов углерода, практически не имеют запаха и вкуса.
Ненасыщенные жирные кислоты в триглицеридах молочного жира оказывают гораздо большее влияние, чем насыщенные, на его физические и химические свойства.
Наличие двойных связей у ненасыщенных жирных кислот объясняет большое количество изомерных форм, которые могут переходить из одной в другую, легкую окисляемость кислородом воздуха, способность к реакциям с галогенами, что используется для определения ненасыщенности молочного жира.
В составе триглицеридов жира преобладают насыщенные кислоты, их общее содержание колеблется от 58 до 77% (среднее составляет 65%), достигая максимума зимой и минимума летом. Среди них преобладают пальмитиновая, миристиновая и стеариновая.
Среди ненасыщенных жирных кислот, составляющих в среднем 35% (при колебании летом 34. 47%, зимой — 25. 39%) преобладает олеиновая.
Содержание стеариновой и олеиновой кислот повышается летом, а миристиновой и пальмитиновой — зимой. Это связано с разницей в кормовых рационах и с физиологическими особенностями (интенсивностью синтеза отдельных жирных кислот) животных.
По сравнению с жирами животного и растительного происхождения молочный жир характеризуется высоким содержанием миристиновой кислоты и низкомолекулярных летучих насыщенных кислот — масляной, капроновой, каприловой и каприновой, в сумме составляющих 7,4. 9,5% общего количества жирных кислот.
Количество биологически важных полиненасыщенных жирных кислот (линолевой, линоленовой и арахидоновой) в молочном жире по сравнению с растительными маслами невысокое и составляет 3. 5%. Их содержание в жире весной и летом выше, чем осенью и зимой.
Физические и химические свойства жиров. Физико-химические свойства жиров и отдельных фракций триглицеридов определяются составом и расположением жирных кислот в молекулах триглицеридов. Для их характеристики служат так называемые константы, или химические и физические числа жиров. По этим числам оценивают качество молочного жира и, в какой-то степени, его натуральность.
К физическим показателям относятся: температура плавления; температура отвердевания (застывания); показатель преломления и др. К важнейшим химическим числам относятся: число омыления, йодное число, число Рейхерта-Мейссля, число Поленске, кислотное число, перекисное число и др.
Характеристики химических чисел и физических показателей жиров, подготовленные авторами по литературным источникам, приведены в табл. 1.4.
Для выявления возможной фальсификации молочного жира необходимо знание характеризующих чисел других жиров. Кроме того, это необходимо также при производстве молочных продуктов с использованием растительных и других жиров немолочного происхождения. Авторами подготовлена справочная таблица (табл. 1.5), которая позволяет читателю проводить сравнение показателей молочного и других жиров животного и растительного происхождения.
Числа жиров находятся в определенной зависимости между собой, изменение одного числа вызывает изменение другого. Так более низкое число рефракции молока объясняется высоким числом Рейхерта-Мейссля и низким йодным числом.
Числа молочного жира характеризуют качество жира, а также являются факторами, позволяющими регулировать технологические процессы. Например, йодное число одновременно является показателем консистенции масла и служит для выбора режима переработки сливок в масло.
Из химических свойств жира для промышленности наибольшее значение имеют те, которые могут привести к изменениям молочного жира в процессе производства или хранения молочных продуктов. К ним относятся прежде всего ненасыщенность жира и способность его гидролизоваться, окисляться, осаливаться, прогоркать.
Гидролиз, или омыление является типичной реакцией для жира. Для гидролиза глицеринов в молоке необходимо наличие активной липазы и воды. При этом образуются ди- и моноглицериды, а также свободные жирные кислоты. О степени гидролиза молочного жира судят по количеству образовавшихся свободных жирных кислот.
Окисление жира характеризуется глубокими изменениями его состава и образованием перекисей, альдегидов, кетонов, оксикислот, дикарбоновых кислот, эфиров и других соединений, влияющих на вкус молочного жира. Окисление протекает в присутствии кислорода воздуха, при повышенных температурах, световом облучении и наличии катализаторов, например ионов тяжелых металлов. Окисление жира может идти ферментативным и неферментативным путем. При ферментативном окислении микроорганизмы выделяют ферменты, катализирующие реакции окисления насыщенных свободных жирных кислот и глицеридов. Перекисное окисление является результатом взаимодействия жира с молекулярным кислородом. При этом прежде всего окисляются свободный жир и ненасыщенные жирные кислоты. Насыщенные кислоты также способны окисляться и образовывать перекиси, хотя и очень медленно.
Характеристика молочного жира
| Наименование | Назначение | Характеристика молочного жира |
| Число омыления | Характеризует среднюю молекулярную массу смеси жирных кислот жира: чем больше в нем содержится низкомолекулярных кислот, тем оно выше | Выражается количеством (в мг) КОН, необходимым для омыления глицеридов и нейтрализации свободных жирных кислот, входящих в состав 1 г жира |
| Йодное число | Показывает содержание ненасыщенных жирных кислот в жире | Выражается количеством (в г) иода, присоединяющегося к 100 г жира. Йодное число молочного жира зависит от кормовых рационов, стадии лактации, времени года, породы животного и т. п. Оно повышается летом и понижается зимой |
| Число Рейхтера-Мейссля | Характеризует наличие в 5 г жира низкомолекулярных жирных кислот (масляной и капроновой), способных растворяться в воде и испаряться при нагревании | Находится в прямой зависимости от числа омыления и повышается к середине периода лактации, а понижается в октябре-ноябре. Жир молока, в отличие от других жиров, имеет высокое число Рейхтера-Мейссля, поэтому по его величине можно ориентировочно судить о натуральности молочного жира |
| Число Поленске | Характеризует наличие в 5 г жира низкомолекулярных летучих нерастворимых в воде жирных кислот (каприловой. каприновой и. частично, лауриновой) | — |
| Число рефракции | Характеризует способность жира преломлять луч света, проходящий через него | Чем больше в жире ненасыщенных жирных кислот, тем выше коэффициент преломления (число рефракции) |
| Температура плавления жира | Температура, при которой жир переходит в жидкое состояние (и становится совершенно прозрачным) | Молочный жир является смесью триглицеридов с различными температурами плавления, поэтому его переход в жидкое состояние происходит постепенно, то есть он не имеет резко выраженной температуры плавления |
| Температура отвердевания жира (застывания) | Температура, при которой жир приобретает твердую консистенцию | Она несколько ниже температуры плавления, что обусловлено явлением переохлаждения триглицеридов (их перераспределением с образованием более высокой кристаллической модификации) |
| Показатель преломления | Характеризует способность жира преломлять луч света, проходящий через него | Чем больше в составе жира ненасыщенных и высокомолекулярных жирных кислот, тем выше его показатель преломления, который можно пересчитать в число рефракции |
Физико-химические показатели различных жиров
Процесс окисления, в результате которого образуются вещества, придающие специфические резкий прогорклый вкус и запах, называется прогорканием.
Осаливание характеризуется появлением сального привкуса, повышением температуры плавления и обесцвечиванием жира. Подобные изменения жира обусловлены образованием оксисоединений, и в частности оксикислот. Перекись водорода, образующаяся в результате взаимодействия атомарного кислорода с водой, при окислении жира вступает в реакцию с непредельными соединениями с получением диоксисоединений. Осаливание жира интенсивно происходит под воздействием ультрафиолетового облучения. Обесцвечивание молочного жира при осаливании обусловлено окислением каротина.
Фосфолипиды и гликолипиды. В состав омыляемой липидной фракции наряду с простыми липидами входят разнообразные фосфолипиды, продукты их распада и гликолипиды (цереброзиды). Фосфолипиды (а также гликолипиды) содержатся в оболочках жировых шариков. В молоке фосфолипиды представлены главным образом лецитином, кефалином и сфингомиелином, составляющими в сумме 0,02. 0,06%.
Технологическая обработка молока вызывает перераспределение фосфолипидов между фазами. Так, при гомогенизации и пастеризации 5. 15% фосфолипидов оболочек шариков жира переходит в водную фазу. При сепарировании молока 65. 70% фосфолипидов переходит в сливки (а при сбивании сливок — 55. 70% — в пахту).
Фосфолипиды обладают эмульгирующей способностью, так как их молекулы построены из двух частей: полярной (несущей электрические заряды «головки»); неполярной (двух углеводородных цепей — «хвостов»). На поверхности раздела «жир-плазма» они образуют мономолекулярный слой: неполярная часть ориентируется к жиру, полярная — к плазме.
Вследствие большого содержания ацилов полиненасыщенных жирных кислот фосфолипиды относительно легко окисляются кислородом воздуха, особенно при наличии меди и железа и под действием тепла. Образующиеся в результате окисления жирных кислот карбонильные и другие соединения могут быть причиной появления в молочных продуктах посторонних привкусов, в частности — олеистого привкуса. Однако фосфолипиды также обладают свойствами антиокислителей.
Вещества, сопутствующие ацилглицеринам. К ним относятся стерины и их эфиры, жирорастворимые витамины (содержание и свойства жирорастворимых витаминов будут рассмотрены ниже), пигменты, а также углеводороды и свободные жирные кислоты. Они растворены в молочном жире, частично входят в состав оболочек шариков жира, и лишь незначительная их часть находится в плазме молока.
Стерины (стероиды). Содержание стеринов составляет: в молоке 0,012. 0,014%; в молочном жире 0,2. 0,4%. Стерины молока представлены в основном холестерином (холестеролом). В небольших количествах и в виде следов встречаются стерины животного и растительного происхождения (ланостерин, 7-дегидрохолестерин, эргостерин, β-ситостерин и др.).
Жирорастворимые пигменты. Желтая окраска молочного жира обусловлена наличием в нем группы веществ, называемых каротиноидами. К ним относятся тетратерпеновые углеводороды — каротины (α, β, γ) и спирты — ксантофиллы. β-Каротин является провитамином А. Содержание каротинов зависит в первую очередь от кормовых рационов, фиэкологического состояния животных, времени года и составляет 0,02..0,09 мг в 100 г молока.
Углеводороды. В неомыляемой фракции липидов молока выделено несколько углеводородов с четным и нечетным числом атомов углерода, в том числе обнаружены следы ациклического тритерпенового углеводорода — сквалена, а также следы дитерпенов и сесквитерпенов растительного происхождения.
Свободные жирные кислоты. Эти кислоты в небольшом количестве всегда присутствуют в молоке и молочном жире. В результате гидролиза жира под действием липаз количество свободных жирных кислот увеличивается. По количеству свободных кислот (масляной, капроновой и др.) судят о вкусе молока, сыра и других продуктов. Например, при их содержании более 20 мг в 100 г молока, продукты приобретают прогорклый и другие посторонние привкусы.
Углеводы. Основным углеводом молока является лактоза; моносахариды (глюкоза и галактоза) присутствуют в нем в меньшем количестве, олигосахариды — в виде следов.
После удаления из молока жира и белка остается молочная сыворотка, представляющая собой истинный раствор лактозы, а также водорастворимых витаминов и минеральных солей (в молоке часть лактозы связана с другими углеводами и белками). Содержание лактозы в молоке довольно постоянно и составляет 4,5. 5,2%. Оно зависит от индивидуальных особенностей и физиологического состояния животных. Так, при заболевании коров маститом резко снижается концентрация лактозы в молоке.
Лактоза находится главным образом в виде двух гидратных α- и β-форм. Формы лактозы различаются пространственным расположением ОН-групп по отношению к первому атому углерода глюкозы. β-Лактоза слаще α-лактозы. обладает большей растворимостью, кристаллизуется из растворов при температуре выше 93,5°С.
Из физических свойств лактозы наиболее важными являются растворимость и способность к кристаллизации. В пересыщенных растворах молока лактоза легко кристаллизуется, образуя характерные кристаллы длиной 10. 20 мкм и более крупные (100. 150 нм) в сыворотке. При температуре ниже 93,5 °С она выделяется с одной молекулой кристаллизационной воды в α-гидратной форме; при температуре выше 93,5°С — в безводной β-форме. Кристаллизация лактозы из пересыщенного сывороточного сиропа является одной из стадий технологического процесса при производстве лактозы.
При нагревании водных растворов лактозы до температуры 100°С (в щелочной среде до более низкой температуры) происходит трансформация глюкозы во фруктозу и образуется лактулоза. Кристаллическая лактулоза хорошо растворяется в воде, в 1,5. 2 раза более сладкая, чем лактоза. Ее широко применяют в производстве продуктов детского питания, так как она стимулирует развитие бифидобактерий в кишечнике детей.
Лактоза под действием раствора сильных щелочей и кислот подвергается гидролизу. Гидролиз лактозы может быть осуществлен ферментативным путем — с помощью β-галактозидазы (лактазы), получаемой из дрожжей и микроскопических грибов.
Ферментативный гидролиз и глубокий распад (брожение) лактозы происходят в молоке и сырной массе под воздействием ферментов молочнокислых бактерий. Основным продуктом сбраживания лактозы является молочная кислота. Молочнокислое брожение лактозы — основной процесс при производстве сыров.
Минеральные вещества. Общее содержание минеральных веществ в пищевых продуктах характеризуется понятием «зола», которую получают путем сжигания и сухого озоления определенной навески продукта (молока). Количество золы в молоке составляет 0,6. 0,8%.
Минеральные вещества поступают в организм животного и переходят в молоко главным образом из кормов и минеральных добавок. Поэтому их количество в молоке находится в прямой зависимости от рационов кормления, окружающей среды (состава почвы, воды и т. п.), времени года, а также от породы животного и его физиологических особенностей.
Все минеральные вещества подразделяются на макро- и микроэлементы. Среднее содержание макро- и микроэлементов молока приведено выше.
Макроэлементы. Основными макроэлементами являются кальций, фосфор, магний, калий, натрий и хлор. Они находятся в молоке главным образом в виде солей фосфорной и лимонной кислот.
Кальций, магний и фосфор — это наиболее важные макроэлементы молока, которые находятся в нем в легкоусвояемой форме и в хорошо сбалансированных соотношениях. Они имеют исключительно важное физиологическое и биохимическое значение для животных и человека, особенно для новорожденных. Их соединения также играют большую роль в процессах переработки молока.
Содержание кальция колеблется от 100 до 140 мг в 100 см3 молока. Оно зависит от рационов кормления, породы животных, стадии лактации и времени года. Около 22% всего кальция прочно связано с казеином, остальное количество (78%) составляют соли: фосфаты — в виде Са3(Р04)2, СаНР04, Са(Н2Р04)2 и других более сложных солей; цитраты — в виде Са3(С6Н507)2, Са(С6Н607).
Кальций присутствует в молоке в основном в коллоидной форме (30% — в виде коллоидного фосфата кальция и около 40% — в виде казеинат-кальцийфосфатного комплекса). На долю истинного раствора приходится около 30% всего кальция, из которого только 7. 10% ионизировано, что составляет 7. 11,5 мг/см3. Соотношение этих форм кальция играет важную роль в поддержании определенной степени дисперсности, гидратации белковых частиц, прохождении сычужного свертывания, а также их стабилизации при тепловой обработке [1,2, 9].
Нормальной концентрацией кальция считается величина равная 120 мг/см3, если она уменьшается до 80 мг/см3, молоко становится «сычужновялым» (при его концентрации более 160 мг/см3 молоко легко свертывается при повышении температуры). Оптимальным содержанием кальция в молоке для сыроделия считается 125. 130 мг/см3.
Количество магния в молоке составляет 12. 14 мг%. Состав солей магния аналогичен составу солей кальция, но на долю солей, находящихся в виде истинного раствора, приходится 65. 70% магния. Остальное количество магния входит в состав коллоидного фосфата магния, а также связано с казеином.
Соли калия и натрия содержатся в виде истинного раствора — в виде хорошо диссоциирующих хлоридов, фосфатов и цитратов. Они имеют большое физиологическое значение — создают нормальное осмотическое давление крови и молока, а также входят в состав буферных систем.
Микроэлементы. К микроэлементам, составляющим в сумме 0,1% всех минеральных веществ, относятся: железо (Fе), медь (Сu), цинк (Zп), марганец (Мn), кобальт (Со), иод (I), молибден (Мо), фтор (F), алюминий (Аl), кремний (Si), селен (Sе), олово (Sn), хром (Сr), свинец (Рb) и др.
Микроэлементы молока условно можно подразделить на «естественные», то есть поступившие в молоко из клеток молочной железы коровы, и «внесенные», то есть попавшие в молоко с поверхности тары и оборудования.
Многие микроэлементы имеют огромное физиологическое значение для новорожденного теленка и обусловливают в значительной степени пищевую и биологическую ценность молока для человека. Они обеспечивают построение и активность жизненно важных ферментов, витаминов и гормонов. Молочнокислые бактерии, входящие в состав бактериальных заквасок, чувствительны к содержанию некоторых микроэлементов в молоке (Fе, Мn. Со и др.).
Однако загрязнение молока медью, железом, оловом, цинком и особенно свинцом, ртутью, кадмием и мышьяком представляет угрозу для здоровья человека. Поэтому их содержание в молоке ограничено предельно-допустимыми уровнями.
Ферменты. В молоке имеются нативные (истинные) ферменты, попадающие в него из секреторных клеток молочной железы или непосредственно переходящие из крови. Из молока, полученного от здоровых животных при нормальных условиях их содержания, выделено более 20 нативных ферментов различных классов (оксидоредуктаз, трансфераз, гидролаз, лиаз и др.) [1,9, 16].
Кроме нативных ферментов в молоке содержатся многочисленные микробные ферменты (внутриклеточные и внеклеточные), продуцируемые микрофлорой, попадающей в молоко из воздуха и других источников в процессе получения, хранения и транспортирования, а также в составе бактериальных заквасок.
Ферменты, встречающиеся в молоке и молочных продуктах, имеют большое практическое значение. Так, некоторые ферменты могут вызвать глубокие изменения составных частей молока во время хранения с возникновением различных пороков вкуса и запаха. Распад липидов, белков, сбраживание углеводов при производстве сыров происходит под действием целого ряда липолитических, протеолитических, окислительно-восстановительных и других ферментов.
Сыродел должен в первую очередь знать свойства оксидоредуктаз и гидролаз.
Оксидоредуктазы. К ним относятся дегидрогеназы, оксидазы, лактопероксидаза и каталаза.
Многочисленные дегидрогеназы (редуктазы) накапливаются в сыром молоке при размножении в нем различных бактерий. По количеству дегидрогеназ судят о бактериальном обсеменении молока (редуктазная проба).
Дегидрогеназы, вырабатываемые молочнокислыми, пропионовокислыми и другими бактериями заквасок (глюкозо-6-фосфат-дегидрогеназа, лактатдегидрогеназа, пируватдегидрогеназа и др.), принимают активное участие в молочнокислом, пропионовокислом, а также в маслянокислом брожениях во время созревания сыров.
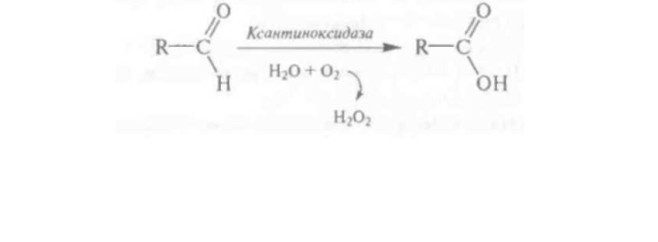
К оксидазам относятся ксантиноксидаза и оксидазы аминокислот.
Ксантиноксидаза (Н. Ф. 1.2.3.2) катализирует окисление пуриновых оснований (гипоксантина и ксантина) до мочевой кислоты, а также различных альдегидов (ацетальдегида и др.) до соответствующих кислот. В молоке он с большей скоростью окисляет альдегиды, чем пурины.
Образующийся в процессе окисления альдегидов Н2О2 обладает бактерицидным действием (при высокой концентрации) и (или) может активизировать антибактериальную лактопероксидазную систему.
Лактопероксидаза (Н. Ф. 1.11.1.7) содержится в коровьем молоке (женское молоко содержит миелопероксидазу — пероксидазу, выделяемую лейкоцитами) в значительном количестве; фермент термостабилен, инактивируется при температуре около 80°С. Пероксидазы обычно катализируют следующую реакцию окисления:
Лактопероксидаза входит в состав антибактериальной системы молока по отношению к бактериям родов Escherichia, Pseudomonas, Salmonella и др. Система содержит три компонента — лактопероксидазу, Н202 и тиоциамат. Тиоцианат (SCN-) образуется в молоке из тиосульфата и цианида под действием фермента роданезы; Н202 является продуктом метаболизма молочнокислых и других бактерий, содержащихся в молоке, а также окисления ацетальдегида ксантиноксидазой.
При взаимодействии всех трех компонентов происходит окисление тиоцианата с образованием гипотиоцианата (OSCN-), являющегося сильным окислителем, который система использует для атаки бактерий.
Для стабилизации качества сырого молока в тропических странах рекомендуют данную антибактериальную систему активизировать путем незначительного повышения концентрации Н202 или тиоцианата.
Каталаза (Н. Ф. 1.11.1.6) окисляет пероксид водорода:
Каталаза переходит в молоко из крови, а также вырабатывается бактериями и лейкоцитами. В свежем молоке с низким количеством микрофлоры каталазы содержится мало. Однако ее количество резко повышается при бактериальном обсеменении молока, мастите, и в начале лактации (в молозиве). Определение активности каталазы используют для контроля анормального молока и выявления его обсемененности психротрофной микрофлорой.
Гидролазы. В молоке обнаружены липазы, фосфатазы, протеазы и другие менее важные гидролитические ферменты.
К липолитическим ферментам относятся липаза (Н. Ф. 3.1.1.3), липопротеидлипаза (Н. Ф. 3.1.1.34) и различные фосфолипазы (Н. Ф. 3.1.1.4; Н. Ф. 3.1.4.3; Н.Ф. 3.1.4.4 и др.) [1.9, 15, 16].
Гидролиз триацилглицеринов молочного жира осуществляют липаза (адсорбируемая на оболочках жировых шариков) и липопротеидлипаза (связанная с мицеллами казеина). Механизм их действия на жир аналогичен и происходит по уравнению:
Нативная липаза молока показывает активность при рН 6. 10, липопротеидлипаза — при рН 8,7. 9.
Кроме нативных липаз расщепление молочного жира осуществляют многочисленные липолитические ферменты, выделяемые микрофлорой молока, особенно психротрофными бактериями родов Pseudomonas, Achromobacter, Alcaligenes, Micrococcus, Bacillus и др.
Бактериальные липазы термостабильны, обладают высокой активностью и могут вызвать прогоркание молока вследствие накопления низкомолекулярных жирных кислот (масляной, капроновой и др.).
Липолитические ферменты заквасочных культур (молочнокислых и пропионовокислых бактерий) принимают участие в формировании органолептических показателей сыров. Среди молочнокислых бактерий особенно активны термофильные палочки и стрептококки — L. helveticum, L. lactis, Str. thermophilus (M. С. Уманский).
Пропионовокислые бактерии (P. shermanii и др.) обладают более высокой липазной активностью по сравнению с молочнокислыми бактериями. И особенно высокой липазной активностью отличаются плесени рода Pénicillium (Реn. album, Реn. candidum, Реn. roqueforti и др.) и дрожжи родов Candida, Torulopsis и др.
Фосфолипазы (A1, A2, С, D и др.) катализируют гидролиз фосфолипидов с образованием жирных кислот и других продуктов:
Нативные фосфолипазы молока имеют незначительную активность, более активны фосфолипазы. продуцируемые психротрофными бактериями, — в результате их работы молоко может приобрести «окисленный» и «рыбный» привкусы.
В настоящее время хорошо изучена фосфолипазная активность молочнокислых бактерий. Высокая активность характерна для Leu. cremoris, средняя — для Lac. lactis и Lac. diacetilactis, низкая — для Lac. cremoris. Пропионовокислые бактерии обладают сравнительно высокой фосфолипазной активностью. Так, около 47,5% всех изученных штаммов, по данным М. С. Уманского и Г. А. Козловой, показали высокий уровень активности. Продукты гидролиза фосфолипидов принимают важное участие в формировании вкуса сыров [15].
В свежевыдоенном молоке обнаружены щелочная и незначительное количество кислой фосфатазы (Н. Ф. 3.1.3.1; Н. Ф. 3.1.3.2). Фермент гидролизуют различные эфиры фосфорной кислоты с образованием неорганического фосфата:
Щелочная фосфатаза (с оптимумом рН 9,6) попадает в молоко из клеток молочной железы и концентрируется на оболочках жировых шариков. Она чувствительна к повышенной температуре; кислая фосфатаза (с оптимумом рН около 5) термостабильна. Высокая чувствительность щелочной фосфатазы к нагреванию положена в основу метода контроля эффективности пастеризации молока.
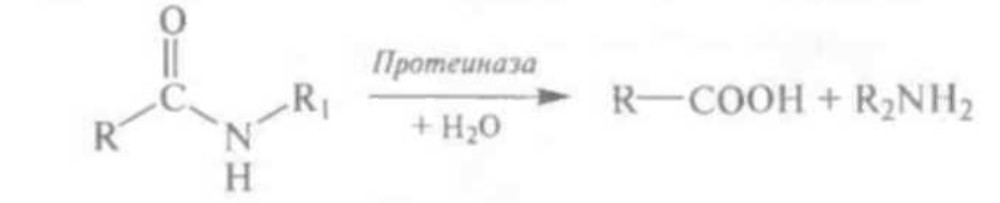
В молоке содержатся разнообразные нативные и бактериальные протеиназы (протеазы), отличающиеся строением каталитического центра, оптимум рН и субстратной специфичностью. Все они катализируют гидролиз пептидных связей белков (казеина) молока:
К нативным протеиназам молока относится главным образом щелочная (сериновая) протеиназа — плазмин (содержание второй щелочной протеиназы — тромбина, а также кислой потей пазы в молоке незначительно) [1, 16].
Плазмин (Н. Ф. 3.4.21.7) попадает в молоко из крови, содержится в основном в виде профермента — плазминогена (его количество в 6. 8 раза выше содержания плазмина).
Механизм перехода плазминогена в плазмин до конца не выяснен. Обнаружены активаторы и ингибиторы этого процесса. Активаторами являются ионы кальция, хлорид натрия (в концентрации 2%) и др. В качестве ингибитора может выступать β-лактоглобулин. Молекулярная масса плазмина составляет 48 000, по-видимому, он может находиться также в виде димера с массой около 100 000. Фермент работает в интервале температур 5. 55°С и при рН 6,5. 9 [17].
Плазмин достаточно термостабилен. Так, пастеризация молока при температуре 72 ± 2°С в течение 15 с снижает активность фермента и его предшественника лишь на 10%. По некоторым данным, пастеризация молока может повысить активность фермента на 30. 40%, вероятно, за счет инактивации ингибитора плазмина.
Фермент проявляет специфичность по отношению к фракциям казеина — наиболее чувствителен к плазмину β- и αs2-казеин. Действие плазмина на β-казеин ведет к разрыву пептидных связей с остатками лизина с образованием γ-казеинов и фосфопептидов. По-видимому, расщепление β-казеина под действием плазмина с образованием γ-казеинов происходит при производстве некоторых видов сыров (чеддер, гауда, мягкие сыры, созревающие при участии микрофлоры сырной слизи и др.). Оптимальные условия для работы плазмина — высокий рН (6,2) и низкая концентрация NaСL (около 2%). Таким образом, при определенных условиях β-казсин может подвергаться активному протеолизу, влияя на консистенцию белковых сгустков и качество готового сыра.
Психротрофные бактерии, попадающие в молоко, выделяют активные протеиназы, которые могут вызвать различные пороки вкуса молока и молочных продуктов.
Молочнокислые бактерии заквасок продуцируют кислые протеиназы, которые могут иметь важное значение при производстве сыров. Лактококки и стрептококки обладают более низкой протеолитической активностью по сравнению с молочнокислыми палочками, особенно термофильными лактобактериями.
Амилаза и лизоцим — это ферменты, гидролизующие гликозидные связи в различных соединениях.
В нормальном молоке содержится в основном α-амилаза (Н. Ф. 3.2.1.1). Фермент катализирует расщепление полисахаридных цепей крахмала с образованием декстринов и мальтозы. В нормальном молоке содержится небольшое количество α-амилазы. При заболевании коров маститом ее содержание повышается. Фермент термолабилен — нагревание молока до 63°С в течение 30 мин инактивирует α-амилазу полостью.
Лизоцим, или мурамидаза (Н. Ф. 3.2.1.17) катализирует гидролиз гликозидных связей в полисахаридах клеточных стенок бактерий, вызывая их гибель. Он губительно действует на патогенные стрептококки и стафилококки, эшерихии, сальмонеллы и другие возбудители мастита животных.
Коровье молоко содержит небольшое количество лизоцима (около 0,2 мкг/мл), в женском молоке его во много раз больше. С учетом также низкого уровня в коровьем молоке другого защитного вещества — лактоферрина, по-видимому, главным фактором естественного (неспецифического) иммунитета следует считать лактопероксидазную систему молока. Для сравнения, в женском молоке именно высокое содержание лизоцима и лактоферрина (вместе с секреторным иммуноглобулином А) обусловливает его бактерицидное и бактериостатическое действие.
Антибактериальные компоненты. В течение определенного времени в свежевыдоенном молоке размножение микроорганизмов не происходит из-за наличия в нем антимикробиальных веществ. Время, в течение которого в молоке не размножаются микроорганизмы, называют бактерицидной фазой
Продолжительность бактерицидной фазы зависит от температуры и степени обсеменения молока микробами. В неохлажденном молоке микроорганизмы начинают размножаться уже через 2 ч после выдаивания, в молоке, охлажденном сразу после выдаивания до 10°С, — примерно через 24 ч.
Естественные антимикробиальные вещества молока полностью разрушаются при нагревании его до 95°С в течение 5 мин. Изучены антимикробиальные вещества двух типов ингибирования: специфического (иммуноглобулины, клеточный иммунитет, фагоцитоз) и не специфический (лизоцим, лактоферрин, система лактопероксидаза).
Специфический тип ингибирования. Иммуноглобулины. Переходят в молоко из крови, а также образуются в самой молочной железе. Образование специфических иммуноглобулинов в молочной железе индуцируется антигенами из кишечника коровы, микроорганизмами, попавшими в железу через сосковый канал, из доильных машин, от телят подсосного периода и из других объектов внешней среды. Содержание иммуноглобулинов в молозиве достигает 15%, что предохраняет телят от инфекции в период, пока не сформировались их собственные защитные силы.
Клеточный иммунитет. Клеточный иммунитет обусловлен наличием в молоке клеток В- и Т-лимфоцитов, которые способны реагировать на бактериальные клетки, попавшие в молоко (антигены) и образовывать специфические антитела, уничтожающие эти микроорганизмы.
Фагоцитоз. В 1 мл нормального молока содержится (1. 3) Ч 105 соматических клеток, из которых 80. 90% составляют эпителиальные клетки, не более 8% полиморфноядерные лейкоциты и лимфоциты, менее 1% — макрофаги. В 1 мл молока из инфицированных долей вымени количество соматических клеток повышается до 106. 107, из которых > 90% являются полиморфноядерные лейкоциты и лимфоциты, обладающие в молоке пониженной бактерицидной активностью, так как захватывают жировые шарики и казеин.
Неспецифический тип ингибирования. Лизоцим. Лизоцим молока обладает значительно большей активностью и более широким спектром действия, чем наиболее изученный из лизоцимов — лизоцим яичного белка.
Лактоферрин. Лактоферрин — белок, связывающий железо, встречается в молоке и других биологических жидкостях, полиморфноядерных лейкоцитах и лимфоцитах. Лактоферрин связывает Fe только в присутствии бикарбонатов (моль/моль). Бактериостатическое действие лактоферрина исчезает в присутствии цитратов и усиливается в присутствии специфических антител. В женском молоке, по сравнению с коровьим, лактоферрина содержится примерно в 100 раз больше.
Система лактопероксидаза (тиоцинат, перекись водорода). В лактопероксидазной системе лактопероксидаза катализирует окисление тиоцинатов перекисью водорода, промежуточные продукты этого окисления задерживает рост многих микроорганизмов. Лактопероксидазы и тиоцинаты попадают в молоко из организма коровы, перекись водорода образуют сами микроорганизмы, в том числе молочнокислые бактерии. Тиоцинаты могут образовываться из глюкозидов непосредственно в молоке под действием фермента роданазы.
Витамины. В молоке содержатся практически все витамины, необходимые для нормального развития новорожденного в первые недели и дальнейшей его жизни.
Большинство витаминов поступает в организм животного с кормом и синтезируется микрофлорой. Содержание витаминов в сыром молоке зависит от кормовых рационов, времени года, физиологического состояния, породы и индивидуальных особенностей животного. При этом зависимость содержания витаминов от состава кормов в большей степени характерна для жирорастворимых витаминов, чем для водорастворимых. Последние могут синтезироваться микрофлорой рубца коровы. Содержание некоторых витаминов в молоке изменяется при его транспортировке, храпении и тепловой обработке.
В сырах обнаруживается большая часть присутствующих в молоке жирорастворимых витаминов и значительное количество водорастворимых витаминов (последние в большом количестве остаются в сыворотке). Микрофлора, участвующая в созревании сыров, обогащает сыры некоторыми витаминами. Например, пропионовокислые бактерии синтезируют в сырах витамин В12, микрофлора поверхностной слизи — фолиевую кислоту. Молоко нормального состава полностью обеспечивает потребность микрофлоры закваски в витаминах. Среднее содержание витаминов в молоке приведено выше.
Жирорастворимые витамины. В молоке присутствуют жирорастворимые витамины А, D, Е, Fи К в активной и неактивной формах (в виде провитаминов).
Витамин А (ретинол) и каротиноиды (провитамины А). Витамин образуется в организме животных из каротинов, которые синтезируются зелеными растениями, а также микроорганизмами рубца. Содержание витамина А повышается в молозиве и в молоке первого месяца лактации и понижается к концу лактации. Наиболее богато витамином молоко летом, когда животные поедают зеленый корм, содержащий много каротина. В течение стойлового периода содержание витамина А снижается, особенно во второй его половине, когда в организме животного истощаются резервы провитамина А. В молоке наряду с витамином А присутствуют каротиноиды, которые легко окисляются кислородом, особенно на свету в присутствии металлов (меди и железа).
Витамин D (кальциферолы). Молоко содержит незначительное количество витамина — в основном D3, который синтезируется в организме животного из провитамина (7-дегидрохолестерина) при УФ-облучении. Летом в молоке содержится витамина D3 в 5. 8 раз больше, чем зимой. Эффективным средством увеличения содержания витамина в молоке является облучение животных ультрафиолетовыми лучами и скармливание им препаратов этого витамина. В сыры витамин D3, почти полностью переходит с жиром.
Витамин Е (токоферолы). В молоке содержится наиболее активный α-токоферол. Токоферолы термоустойчивы, но легко окисляются, особенно при УФ-облучении. Витамин Е является антиоксидантом и предотвращает окисление липидов, витамина А, β-каротина. Стабилизатором витамина Е является аскорбиновая кислота. В сыры переходит большая часть токоферолов молока.
Водорастворимые витамины. К водорастворимым витаминам молока относятся витамины группы В, биотин (Н), аскорбиновая кислота (С) и др.
Тиамин (витамин В1). В молоке содержится свободный тиамин (50. 70% всего количества), а также в форме тиаминдифосфата, остальное количество связано с белком. Количество тиамина в молоке в течение года практически постоянно, то есть не зависит от состава кормов.
Рибофлавин (витамин В2). В молоко переходит из корма и синтезируется микрофлорой рубца животных. В молоке 65. 69% витамина содержится в свободном состоянии, а часть в виде коферментов (ФМН и ФАД) входит в состав окислительно-восстановительных ферментов молока. Обладает свойствами желто-зеленого пигмента и обуславливает окраску молочной сыворотки. Молоко и молочные продукты являются основным источником витамина В2 для человека. Концентрация рибофлавина в сырах в 2. 3 раза выше, чем в молоке.
Пантотеновая кислота (витамин В3). Участвует в синтезе кофермента А, обмене жирных кислот, липидов и стеринов. Является фактором роста для молочнокислых, пропионовокислых бактерий и дрожжей, при ее недостатке в молоке замедляется рост бактериальных культур заквасок. Синтезируется растениями и микрофлорой желудочно-кишечного тракта животных. Концентрация В3 в сырах примерно такая же, как и в молоке.
Ниацин (витамин РР). В молоке содержится мало витамина РР, но молочные белки богаты триптофаном, который в организме животного и человека метаболизируется до никотиновой кислоты. Витамин синтезируется микроорганизмами рубца животного, его содержание в молоке относительно стабильно. Витамин РР устойчив к повышенным температурам, свету и окислителям. Концентрация в сырах ниацина возрастает по сравнению с молоком.
Пиридоксин (витамин В6). Витамин входит в состав ферментов, катализирующих переаминирование и декарбоксилирование некоторых аминокислот. Синтезируется растениями, микрофлорой пищеварительного тракта. Содержание в молоке зависит от стадии лактации. В цельном молоке небольшая часть витамина находится в связанной форме, а большая часть — в свободной. Концентрация пиридоксина в сырах в 2. 3 раза выше, чем в молоке.
Витамин В12 (цианокобаламин). Синтезируется микрофлорой рубца и кишечника животных, а также поступает с кормами животного происхождения (рыбная, мясокостная мука, сыворотка и др.). Принимает участие в метаболизме пропионовой кислоты, синтезе нуклеиновых кислот, метионина, холина и др. В молоке значительная часть витамина В12 связана с защитным белком. Концентрация витамина В12 в сырах в 3. 4 раза выше, чем в молоке.
Фолацин (фолиевая кислота, витамин Вс). Витамин участвует в процессах кроветворения, синтезе нуклеиновых кислот, холина и других соединений. Вместе с входящей в ее состав парааминобензойной кислотой является фактором роста для многих микроорганизмов. Поэтому недостаток ее и других факторов роста (ниацина, пантотеновой кислоты и биотина) в молоке весной может быть причиной замедленного развития молочнокислых бактерий заквасок. Фолацин синтезируется растениями, большинством микроорганизмов, в том числе микрофлорой желудочно-кишечного тракта животных.
Биотин (витамин Н). Витамин, параду с другими витаминами (пантотеновая и фолиевая кислоты), необходим для развития дрожжей и молочнокислых бактерий. В сырах концентрация биотина ниже, чем в молоке.
Аскорбиновая кислота (витамин С). Синтезируется растениями и животными, но не синтезируется человеком. Витамин активно участвует в окислительно-восстановительных процессах, происходящих в молоке. Содержание в молоке зависит от индивидуальных особенностей животных, обычно повышается осенью и зимой, а летом понижается. В свежем молоке содержится 67. 78% восстановленной формы аскорбиновой кислоты и 22. 33% — дегидроаскорбиновой кислоты.
Витаминоподобные соединения. К ним относятся холин, n-аминобензойная кислота, оротовая кислота и некоторые другие.
Холин. Входит в состав некоторых фосфолипидов (лецитина, сфингомиелина), обладает мощным липотропным действием. Синтезируется растениями и животными, но не синтезируется человеком; в молоке содержание холина в течение года относительно стабильно. Концентрация в сырах примерно такая же, как и в молоке.
Парааминобензойная кислота. Имеет большое биологическое значение — является фактором роста микроорганизмов.
Оротовая кислота. Является промежуточным продуктом биосинтеза пиримидиновых оснований (урацила, цитозина и тимина). У млекопитающих оротовая кислота синтезируется из аспарагиновой и карбамоилфосфата. Она способна усиливать рост микроорганизмов и животных. В молоке содержится в сравнительно больших количествах.
Гормоны. В молоко из крови переходят эндогенные гормоны (гормоны, выделяемые эндокринными железами животного) и экзогенные гормоны (гормональные препараты, применяемые для стимулирования молочной продуктивности, усвоения кормов, развития животных и т. д.). По химическому строению некоторые из них являются пептидами и белками, большая группа имеет стероидную структуру, другие представляют собой производные аминокислот и жирных кислот.
К гормонам пептидной природы молока относятся пролактин, окситоцин, соматотропин и др. Пролактин (лактогенный гормон) является гормоном передней доли гипофиза, стимулирует развитие молочных желез, образование и секрецию молока. Окситоцин — это гормон задней доли гипофиза, стимулирующий секрецию молока и синтез белка. Соматотропин (или гормон роста) повышает удои молока при даче препаратов гормона животным.
Из стероидных гормонов в молоке обнаружены кортикостероиды и половые гормоны — андрогены, экстрогены и прогестерон. К гормонам — производным аминокислот и жирных кислот — можно отнести тироксин и простагландины.
Посторонние химические вещества. К посторонним химическим веществам молока, имеющим значение с точки зрения охраны здоровья человека, относится широкий диапазон примесей: антибиотики, пестициды, детергенты, дезинфектанты, тяжелые металлы и мышьяк, радионуклиды, микотоксины, бактериальные яды, нитраты, нитриты, диоксины и др.
Помимо токсичности многие из этих веществ обладают свойством нарушать ход технологических процессов при выработке молочных продуктов, что приводит к снижению качества этих продуктов и их пищевой ценности.
Уровень загрязненности молока химическими примесями подлежит систематическому контролю в соответствии с принятыми стандартами, регламентирующими их содержание. Ниже приведены гигиенические требования к качеству и безопасности молока как продукта продовольственного сырья и пищевого продукта (допустимые уровни) [21]:
| Антибиотики: | |
| Левомицетин | Не допускается |
| Тетрациклиновая группа | То же |
| Стрептомицин | То же |
| Пенициллин | То же |
| Пестициды, мг/кг, не более: | |
| гексахлорциклогексан (α-, β- и γ-изомеры) | 0.05 |
| ДДТ и его метаболиты | 0,05 |
| Токсичные элементы, мг/кг, не более: | |
| свинец | 0,1 |
| мышьяк | 0.05 |
| кадмий | 0.03 |
| ртуть | 0,005 |
| Радионуклиды, Бк/л: | |
| Цезий-137 | 100 |
| Стронций-90 | 25 |
| Микотоксины: афлатоксин М1 | 0,0005 |
Кроме естественных антибактериальных систем молока, которые мы рассматривали выше, в перерабатываемом сырье могут быть ингибиторы роста бактерий, отсутствующие в нормальном молоке. Последние попадают в молоко при использовании недоброкачественных кормов или лечении коров химическими препаратами, а также в результате жизнедеятельности нежелательной микрофлоры.
При загрязнении молока антибиотиками, лекарственными веществами и дезинфицирующими соединениями ухудшаются гигиенические свойства молока. Употребление его в пищу может привести к возникновению аллергических заболеваний.
Антибиотики. При лечении мастита и других заболеваний животных широко применяют различные антибиотики (антибиотики также могут вносить в корма или молоко при его фальсификации): пенициллин, стрептомицин, окситетрациклин (терромицин), левомицетин и др. Наиболее широкое распространение в ветеринарной практике нашли антибиотики пенициллинового ряда.
Растворы антибиотиков вводят внутримышечно или непосредственно в пораженные бактериальными инфекциями доли молочной железы лактирующих животных. При этом 10. 40% используемой дозы антибиотиков переходят в молоко в течение 48. 72 ч и более после инъекции в молочную железу. Содержание антибиотиков в молоке зависит от дозы, свойств применяемого препарата и индивидуальных особенностей животного.
Тепловая обработка молока лишь незначительно разрушает антибиотики. Так, поданным И. И. Архангельского, после пастеризации в молоке остается 72. 94% первоначального количества антибиотиков.
Чувствительность микроорганизмов к антибиотикам представлена в табл. 1.6.
Чувствительность молочнокислых и пропионовокислых бактерий к антибиотикам
| Микроорганизмы | Концентрация антибиотиков, ингибирующих рост микроорганизмов | |||
| Пенициллина, ед./мл | Стрептомицина, мкг/мл | Хлортетрациклина, мг/мл | Окситетрациклина, мг/мл | |
| Lac. lactis | 0,1. 0,3 | — | — | — |
| Lac. cremoris | 0.05. 0.01 | — | — | — |
| Str. thermophilus | 0.0017. 0.17 | 0.05. 5.00 | 0,001. 0,01 | 0.001. 0.01 |
| Lac. diacetylactis | 0.25 | — | — | — |
| L. helveticum | 0,025. 0,050 | — | — | — |
| L. lactis | 0,025. 0.050 | — | 0,3. 3,0 | — |
| L. bulgaricum | 0,030. 0.060 | — | 0.3. 5,0 | — |
| Leu. cremoris | 0.05. 0.10 | — | — | — |
| P. shermanii | 0,05 | — | — | — |
| Закваска для сыра (мезофильная) | 0.05….0,20 | 0,04 | 0,02. 0.025 | 0.01 |
Наиболее чувствительны к антибиотикам термофильный стрептококк и молочнокислые палочки. Антибиотики нарушают сычужное свертывание молока при производстве творога и сыра, что отрицательно сказывается на консистенции и вкусе этих продуктов. Поэтому полученное в течение 2. 5 дней после применения антибиотиков молоко не подлежит сдаче на молочные заводы.
Пестициды. В молоко пестициды попадают через загрязненный корм или кожу при санитарной обработке шерстного покрова животных против насекомых. Для этой цели широко используются фосфорорганические пестициды (карбофос, хлорофос, метафос, фосфамид), а ранее применялись хлорорганические (альдрин, гексахлорциклогексан, ДДТ). Степень перехода в молоко и токсичность этих двух групп соединений различна.
Моющие и дезинфицирующие вещества. Остатки средств для санитарно-гигиенической обработки попадают в молоко при недостаточно тщательном ополаскивании водой доильных установок и оборудования на фермах после использования синтетических моющих или моюще-дезинфицирующих средств. Соблюдение инструкций по мойке и дезинфекции оборудования и технологических трубопроводов на перерабатывающих предприятиях исключает возможность попадания этих средств в молоко, однако при неполадках автоматических устройств и безразборной мойке возможно загрязнение ими молока.
Наличие в молоке моющих веществ ухудшает его технологические свойства — приводит к нарушению процесса получения сгустков при производстве сыров. Наиболее опасны препараты, содержащие сульфонол, активный хлор, йод и четырехзамещенные соединения аммония.
Тяжелые металлы и мышьяк. Некоторые из тяжелых металлов (свинец, ртуть, кадмий) и мышьяк высокотоксичны, другие (медь, цинк и др.) токсичны только при высоких концентрациях, поэтому их предельное содержание регламентировано во всех пищевых продуктах.
В большинстве случаев загрязнение молока наиболее опасными тяжелыми металлами (Рn, Hg, Сd) и мышьяком имеет эндогенное происхождение. Эти токсичные элементы поступают в окружающую среду с отходами промышленных предприятий, выхлопными газами автотранспорта, пестицидами и удобрениями и попадают в организм животных через корм. Отравление коров ртутью и мышьяком также возможно при использовании для кормовых целей зерна, протравленного ртутьсодержащими (гранозан, меркуран) и мышьяковистыми (арсенат кальция) препаратами. Однако в молоко выделяется лишь незначительная часть токсичных веществ. Поэтому молоко по сравнению с другими пищевыми продуктами (мясо, рыба) меньше загрязнено тяжелыми металлами и мышьяком.
Радиоактивные вещества. Источниками радиоактивного загрязнения пищевых продуктов являются радионуклиды, выделяемые в атмосферу при добыче, испытании и хранении ядерного топлива и выпадающие на земную поверхность с атмосферными осадками. Молоко загрязняется искусственными радионуклидами стронция (90Sr, 89Sr), цезия (137Cs), иода (131I) и другими в основном биологическим путем по цепи атмосфера → почва → растения → животные → молоко. Наибольшую опасность для животных и человека представляют радионуклиды с длительным периодом полураспада — 90Sr и 137Cs; для детей также опасен короткоживущий 131I. (При загрязнении молока радиоизотопами его можно очистить с помощью ионообменных смол и альгинатов, задерживающих 75. 95% радиоактивного стронция и цезия. Из такого молока рекомендуется вырабатывать сливочное и топленое масло — в масло переходит менее 1 % общего количества радиоизотопов молока — или сыр и творог кислотным способом.)
Микотоксины, бактериальные и растительные яды. Несомненную опасность представляет развитие в кормах и продуктах питания некоторых видов микроскопических плесневых грибов (Aspergillus, Fusarium, Pénicillium и др.). При поражении кормов (сено, солома, рыбная мука, фураж) микроскопическими грибами в них образуются и накапливаются так называемые микотоксины — афлатоксины, патулин, охратоксин, зеараленон и др. Скармливание заплесневелых кормов может привести к отравлению животных и выделению части микотоксинов в молоко.
К числу наиболее опасных микотоксинов относятся афлатоксины — канцерогенные вещества, синтезируемые грибами Asp. flavus и Asp. parasiticus. Известно и идентифицировано более восьми различных афлатоксинов (В1 В2, G1, G2, M1, М2 и др.). Из них наибольшей токсичностью обладает В1, который в организме млекопитающих переходит в менее опасный метаболит М1.
Ввиду высокой токсичности афлатоксинов ФАО/ВОЗ установлена допустимая их концентрация в кормах для молочного скота 20 мкг/кг. В молоке допустимый уровень содержания афлатоксина М1, установленный СанПиН 2.3.2.1078-01, составляет 0,0005 мг/кг. При пастеризации молока количество афлатоксинов снижается незначительно.
Потенциальную опасность для человека могут представлять токсины бактериального происхождения: энтеротоксины, вырабатываемые коагулазоположительными стафилококками; эндотоксины, продуцируемые грамотрицательными и грамположительными бактериями родов (Salmonella, Escherichia, Proteus, Clostridium, Bacillus и др.).
Энтеротоксины, синтезируемые штаммами Staph. aureus, делятся на семь типов (А, В, С, D, Е и др.). Они представляют собой термоустойчивые белки. Активность их снижается лишь при длительном 2. 3 часовом кипячении или автоклавировании молока. Оптимальные условия для роста Staph. aureus и образования ими энтеротоксинов: температура 40°С, pH 6,5. 7,3. Высокие концентрации NaCl (8. 10% и более) не задерживают их рост и синтез токсинов. Энтеротоксины (оставшиеся в молоке после пастеризации или образующиеся при вторичном обсеменении) могут быть причиной пищевых токсикозов.
Эндотоксины, вырабатываемые бактериями Salm. typhimirium, Е. coli, Р. vulgaris, Cl. perfringens. Bac. cereus и др., при употреблении молочных продуктов, содержащих большое количество живых микробов, вызывают пищевые токсикоинфекции — острые кишечные заболевания (гастроэнтерит).
Иногда молоко загрязняется различными растительными ядами, вызывающими отравления молодых животных и человека. В организм животных они попадают при поедании ядовитых растений (безвременник осенний, белена черная, полевой хвощ, лютик и пр.), неумеренных количеств хлопчатникового жмыха, проросшего картофеля и др.
Нитраты, нитриты и другие посторонние вещества. Молоко обычно содержит незначительное количество нитратов (0,2. 0,8 г/кг) и нитритов (2. 3 мкг/кг). Нитраты корма и образующиеся из них в рубце нитриты почти полностью разрушаются в организме животного. При большом содержании их в некоторых кормах (силос, гидролизные дрожжи и другие) может наблюдаться более активный переход нитратов и нитритов в молоко.
Нитраты и нитриты представляют опасность для человека, так как являются предшественниками синтеза в его организме (и в пищевых продуктах) канцерогенных Н-нитрозаминов (НА) — соединений типа: R-(R1)N-NО.
В группу нитрозируемых предшественников НА входят вторичные и третичные амины (диметил-, диэтил-, триметиламин и др.), содержащиеся во многих пищевых продуктах (сыр, мясо, рыба и т.д.).
К числу посторонних веществ, загрязняющих молоко и молочные продукты, можно отнести следующие соединения: полициклический ароматический углеводород — 3,4-бенз(а)пирен (содержащийся в кормах, дыме, смолах, парафине и т. д.); диоксины и диоксиноподобные соединения; гормональные препараты (эстрадиол 17β и др.); соединения, применяемые в ряде стран в качестве красителей, стабилизаторов, ароматизаторов и других добавок без должной проверки их на пищевую безопасность.