избыточное время флотации приводит к чему в гистологии
Обезвоживание гистологического материала
код для вставки на форум:
ОБЕЗВОЖИВАНИЕ МАТЕРИАЛА
После фиксации, для которой применялся формалин, кусочки промывают в течение 6,12 или 24 ч в проточной воде: на водопроводный кран надевают резиновую трубку, конец которой опускают в широкогорлую банку, закрытую марлей. Для промывки удобно использовать эксикаторы разных размеров, снабженные краном: в отверстие крышки эксикатора опускают шланг, по которому подают воду, а через кран эксикатора ее сливают.
В случае необходимости кусочки тканей перед обезвоживанием можно уменьшить, подровнять. Если материал после фиксации не сразу подлежит проводке, то его можно оставить в 70-80% спирте.
СПОСОБЫ ОБЕЗВОЖИВАНИЯ ТКАНЕЙ
Перед заливкой материала в парафин пли целлоидин его необходимо обезводить. Существует несколько традиционных способов обезвоживания. Самым распространенным является обезвоживание в спиртах восходящей концентрации, начиная с 70 %. Обычно применяют батарею спиртов, состоящую из двух порций 96 % и двух — 100 % спирта. Продолжительность процесса обезвоживания в спиртах в среднем 48 ч в зависимости от качества материала (содержания жира в ткани) и размера кусочков, а также от их количества. При использовании автомата для заливки количество спиртов увеличивают, а при проведении кусочков по спиртовой батарее вручную их осторожно промокают фильтровальной бумагой или салфеткой из марли, что позволяет реже менять спирты в батарее.
Процесс обезвоживания можно ускорить, периодически встряхивая кусочки в банках со спиртами или поместив их в термостат при 37 °С. Спирты в батарее необходимо своевременно заменять. Контролировать пригодность спирта позволяет проба с водой. В отлитое из банки небольшое количество спирта добавляют 1 каплю воды. Помутнение раствора свидетельствует о необходимости замены спирта в батарее.
Абсолютный спирт можно приготовить из 96 %. Для этого применяют сульфат меди, ко-
торый помещают в ступку и прокаливают на спиртовке или в термостате, периодически растирая и размешивая до консистенции пыли и бледно-голубого цвета. Затем сульфат меди (1 часть) засыпают в банку с 96 % спиртом (4 или 6 частей), плотно закрывают ее крышкой, взбалтывают и оставляют на несколько дней, периодически встряхивая. Сульфат меди адсорбирует воду из спирта и вновь приобретает синюю окраску. Перед использованием абсолютного спирта проводят его контроль спиртометром или в пробирку с небольшим количеством ксилола (4—5 мл) добавляют каплю приготовленного спирта (раствор мутнеет, если спирт недостаточно обезвожен). Хорошим адсорбентом воды из спирта является также силикагель после предварительного просушивания его в термостате.
При отсутствии 100 % спирта в батарею включают еще одну порцию 96 % спирта. Однако в этом случае всегда есть опасность недостаточного обезвоживания и возникновения трудностей при получении срезов.
С целью ускорения обезвоживания применяют ацетон без примесей (ЧДА), предварительно добавив в него силикагель для удаления остатков воды или дистиллированный ацетон. Обезвоживание проводят в 2—3 сменах ацетона от нескольких часов до 1 суток в зависимости от величины объектов. Обезвоживание тканей возможно с помощью 99 % изопропилового спирта, который непосредственно смешивается с парафином без промежуточных растворителей (ксилол, хлороформ и др.). Таким же свойством обладает диоксан, однако в связи с высокой токсичностью он не нашел широкого применения в патогистологической технике
Для обезвоживания глицерином [Беккер Г.М., 1958; Wolf J., 1939, и др.] кусочки ткани последовательно помещают в 60 %, 80 % и 100 % глицерин на 3—4 ч, а затем в смесь, состоящую из равных частей 100 % глицерина и ксилола.
Выраженное влияние на скорость обезвоживания оказывает микроволновое излучение. Объекты в 70 % спирте помещают на 20 с в микроволновую печь (2,5 Гц/500 В), а затем дообезвоживают в абсолютном спирте в течение 30—60 мин.
Секционный и биопснйный материал часто обезвоживают в аппаратах типа АТ-5 и др. с последующим пропитыванием толуолом, хлороформом или их смесью с парафином. При этом применяют две порции 96 % спирта и две — 100 %. Общая продолжительность обезвоживания 48 ч. Преимущество использования аппаратов состоит в том, что в них материал постоянно перемешивается и находится во взвешенном состоянии. Однако аппарат не включается автоматически после внезапного перепада напряжения в электрической сети, что может привести к пересу-шиванию большого количества материала.
похожие статьи
Атлас по судебно-медицинской гистологии / Пиголкин Ю.И., Кислов М.А., Должанский О.В., Филиппенкова Е.И., Крупин К.Н. — 2021.
Анализ недостатков судебно-гистологических исследований и пути их устранения / Гедыгушева Н.П., Буланова Э.В. // Матер. IV Всеросс. съезда судебных медиков: тезисы докладов. — Владимир, 1996. — №2. — С. 47-49.
Возможности установления некоторых причин смерти гистохимическими методами / Смирнов В.В., Смирнов В.В. // Матер. IV Всеросс. съезда судебных медиков: тезисы докладов. — Владимир, 1996. — №2. — С. 31-32.
Актуальные вопросы гистологического исследования при экспертизе живых лиц / Кулеша Н.В. // Избранные вопросы судебно-медицинской экспертизы. — Хабаровск, 2018. — №17. — С. 125-128.
Избыточное время флотации приводит к чему в гистологии
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ДАГЕСТАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Предметом изучения цитологии, гистологии и эмбриологии являются клеточно-тканевые структуры организмов на микроскопическом уровне, а предметом изучения – микроскопический препарат. Поэтому для успешного освоения этих наук необходимо владеть гистологической техникой – приемами и методами изготовления микроскопических препаратов и способами их изучения. В настоящем руководстве изложены основные сведения по технике гистологических исследований, оно знакомит студентов с правилами работы и методами наблюдения под микроскопом, методикой приготовления препаратов. Особое внимание уделено методам окрашивания различных клеточно-тканевых структур и гистохимическим исследованиям. Методики применимы на растительных и животных объектах.
Методические указания рекомендованы для студентов, специализирующихся по кафедре физиологии человека и животных, могут быть использованы на лабораторных занятиях по цитологии, гистологии и эмбриологии, большом практикуме, при выполнении курсовых и дипломных работ.
Автор: Газимагомедова И.К. – доц. каф. зоологии и физиологии, канд. биол. наук
Приготовление постоянного микротомного препарата Взятие и фиксация материала …………………………….
Уплотнение (заливка в парафин) ………………………….
Окрашивание и заключение в бальзам ………………….
Методы окрашивания гистологических препаратов …
Методы окраски клеток и неклеточных структур соединительной ткани ……………………………………..
Выявление элементов нервной системы
Приготовления препаратов давленных объектов. Методы изучения митоза и мейоза ………………………
1. Световая Микроскопия
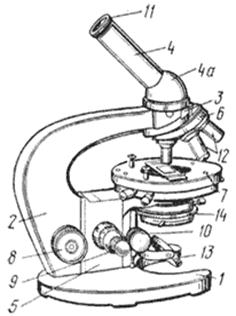
1.1. Устройство микроскопа
В микроскопе различают оптическую (объектив, окуляр), осветительную (источник света, зеркало, конденсор и диафрагма) и механическую (штатив, предметный столик, колонка с макро- и микровинтами, тубус) части (рис. 1).
Рис.1. Световой микроскоп.
Полное увеличение микроскопа оценивают как произведение увеличений объектива и окуляра, например, при объективе 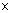
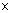
Разрешающая способность объектива, т.е. минимальное расстояние между двумя видимыми точками (минимальный размер объекта):
где: λ – длина волны света, используемого для освещения объекта; n – коэффициент преломления среды (воздух или масло); α – угол между оптической осью объектива и наиболее отклоняющимся лучом, попадающим в объектив (максимально 90°); n ∙ sin α – апертура линз.
Если использовать ультрафиолетовый свет (260 – 280 нм), то можно повысить разрешение до 130-140 нм (0,13 – 0,14 мкм). Это будет пределом теоретического разрешения светового микроскопа, определяемым волновой природой света. Таким образом, все, что может дать световой микроскоп как вспомогательный прибор к нашему глазу – это повысить разрешающую способность его примерно в 1000 – 2500 раз. Это и есть “полезное” увеличение микроскопа, выше которого мы будем только увеличивать контуры изображения, не открывая в нем новых деталей. Следовательно, при использовании видимой области света 0,2–0,3 мкм является конечным пределом разрешения светового микроскопа (минимальное расстояние на котором различимы два объекта).
Зеркало собирает лучи от источника света и направляет их на препарат снизу. При искусственном освещении используется вогнутая поверхность зеркала, а при дневном – плоская.
Конденсор состоит из линз, которые фокусируют лучи света на препарате. Поднимая и опуская конденсор (с помощью винта), можно настраивать фокусировку лучей. При подъеме конденсора попадающие на препарат лучи рассеиваются, при опускании концентрируются на препарате, но на более ограниченном участке. Обычно работают при конденсоре, поднятом до уровня столика.
В итоге, световые лучи проходят следующий путь: источник света → зеркало → конденсор → диафрагма → препарат → объектив → тубус → окуляр. Т.е. микроскопия ведётся в проходящем свете, для чего препарат должен быть достаточно тонким.
1.2. Техника микроскопирования
Изучить препарат при малом увеличении.
Перевести препарат на большое увеличение. Для этого сменяют объектив на 
Для изучения очень мелких структур используют иммерсионный объектив ( 
2. Приготовление постоянного микротомного препарата
Приготовление постоянных гистологических препаратов включает следующие этапы: 1) взятие и фиксация материала; 2) промывка и обезвоживание; 3) уплотнение (заливка в парафин); 4) приготовление срезов; 5) окрашивание; 6) обезвоживание и заключение препаратов в консервирующую среду (рис. 2).
2.1. Взятие и фиксация материала
Необходимое условие при взятии материала – сохранение прижизненной организации тканей. Для этого материал берут «живьем» и быстро убивают, обычно погружая в специальные фиксирующие жидкости, в целях сохранения витальной структуры, т.е. проводят фиксацию.
Рис. 2. Этапы приготовления гистологического препарата для световой микроскопии.
В зависимости от строения органа взятие материала осуществляется по-разному. Из однородных органов (печень, селезенка) кусочек можно вырезать из любого участка. Из неоднородных органов (почка, надпочечник) необходимо так вырезать кусочек, чтобы попали все слои. Величина кусочка зависит от структуры органа, целей исследования и способов дальнейшей обработки. Из соответствующего органа вырезают обычно небольшие кусочки (0,5 x 1 x 1 см ).
Способы фиксации – использование фиксирующих жидкостей, криофиксация (мгновенное замораживание в жидком азоте) и лиофилизация (замораживание с последующим высушиванием в вакууме). При лиофилизации выпадает необходимость проводить обезвоживание и уплотнение материала.
Фиксирующие средства бывают простые и сложные. К первым относятся спирты, ацетон, кислоты, формалин, сулема, пикриновая кислота, тетраоксид осмия. Сложными являются смеси различных веществ, например жидкость Ценкера, жидкость Карнуа, жидкость Буэна и т.д. Так, для лучшей фиксации ядер употребляют хромовые или хромосмиевые смеси, для фиксации цитоплазмы смеси Карнуа или Буэна. Фиксирующие свойства зависят от рН среды, температуры, продолжительности фиксации.
В последнее время, особенно для электронной микроскопии, широко используется глютаровый альдегид, который более эффективно сшивает молекулы и тем самым обладает сильным фиксирующим действием.
Требования, предъявляемые к фиксатору : 1) свежесть; 2) достаточное количество. Объем фиксатора должен в 20-40 раз превышать объем фиксируемого материала, объект со всех сторон должен быть окружен фиксатором. Если часть материала плавает на поверхности фиксатора, то сверху накладывают тонкий слой ваты. Как до, так и после фиксации объект не должен подсыхать на воздухе.
100% или 96% спирт……………………6 частей
Ледяная уксусная кислота…………… 1 часть
Фиксатор готовят перед употреблением. Фиксируют от 30 мин до 3 ч, затем кусочки можно хранить в 70% спирте.
100% или 96% этиловый спирт………. 3 части
Продолжительность фиксации – 2-12 ч. Иногда в нем хранят материал при 0-3 о С.
Двухромовокислый калий………………2,5 г
Сернокислый натрий…………………….1 г
Дистиллированная вода…………………100 мл
Ледяная уксусная кислота………………5 мл (добавляют перед употреблением)
Фиксируют 1-24 ч. Затем 24 ч промывают в водопроводной воде до обесцвечивания воды. Материал обесцвечивают в 70% спирте, где его можно хранить. Цвет фиксатора – насыщенно красно-бордовый. Как только сулема будет удалена, раствор перестанет обесцвечиваться.
100% или 96% спирт…………………….10 мл
Ледяная уксусная кислота………………2 мл
Фиксируют от 5 мин и более. Фиксатор пригоден для приготовления временных давленых препаратов.
5% формалин: 1 часть 40% формалина + 7 частей дистиллированной воды.
10% формалин: 1 часть 40% формалина + 3 части дистиллированной воды.
20% формалин: 1 часть 40% формалина + 1 часть дистиллированной воды.
Методика проведения фиксации. Берется чистая стеклянная посуда (пробирки, бюксы или стаканчики) с фиксатором, объем которого в 20-40 раз больше объема материала. На дно посуды кладут гигроскопическую или стеклянную вату для равномерного пропитывания объекта. Материал с помощью пинцета быстро помещается в фиксирующую смесь (фиксатор должен быстро проникать в ткани и не вызывать грубых нарушений тканевых структур) и посуда плотно закрывается. Вместе с материал в пробирку кладется фиксационная этикетка, сделанная из плотной бумаги, размером 1х1 см, на которой простым карандашом отмечаются название изучаемого материала, фиксатора и дата фиксации.
Если ткань богата водой или кровью, фиксатор следует дважды сменить.
После фиксации образцы промывают проточной водой (в некоторых случаях спиртом) от 1 до 3 ч, иногда дольше. Промывкой материала удаляется излишнее количество фиксатора. В зависимости от способа фиксации существуют разные способы промывки. После фиксации в смеси с пикриновой кислотой промывка производится 70-80% спиртом. При фиксации в смесях, содержащих сулему, трихлоруксусную кислоту, используют 90-96% спирт. При формалиновой фиксации и фиксации хромовыми смесями промывку производят проточной водой под краном, или неоднократной сменой воды (10-12 раз) в течение 24-48 ч. Материал, фиксированный в смесях с преобладанием спирта (фиксатор Карнуа) промывке не подвергается.
Существуют разные приспособления для промывки: 1) обычные стеклянные склянки с пробкой или завязанные марлей и резиновым шлангом, соединенные с краном; 2) для мелких объектов применяются специальные фарфоровые сита; 3) стеклянные трубочки, обвязанные с обеих сторон марлей.
Удобно провести промывку материала следующим образом: материал вместе с этикеткой переносят в марлевые узелки, перевязывают их ниткой и помещают в высокий стакан с водой. Сверху в стакан кладут воронку и все ставят под кран с проточной водой.
Далее необходимо получить срезы материала для их последующего окрашивания. Для этого образцы уплотняют, т.е. заливают в парафин или целлоидин, чтобы в последующем их можно было тонко резать. Предварительно образцы обезвоживают, чтобы гидрофобный уплотнитель смог проникнуть в ткань. Обезвоживание производится проведением материала по батарее спиртов возрастающей концентрации, что позволяет избежать разрывов и деформаций ткани.
Методика обезвоживания. Материал вынимают из марлевых узелков и вместе с этикеткой последовательно помещают в стаканчики или бюксы со спиртами (метанол или этанол) возрастающей концентрации – 70%, 80%, 96%, 100%. Чем нежнее материал, тем ниже первоначальная концентрация спирта (начинают с 20% спирта). Время выдерживания в каждом спирте зависит от толщины материала и строения органа: от 30 мин, 1-6 ч, и до 6-12 ч. В 96% и 100% спиртах выдерживают дважды. При перекладывании материала из слабого раствора спирта в спирт большей концентрации кусочки необходимо обсушить фильтровальной бумагой.
Схема и сроки выдерживания в спиртах растительного материала:
Как проводится гистологическое исследование: виды, методы, особенности
Злокачественные новообразования — это группа заболеваний, насчитывающая несколько тысяч видов опухолей разных типов и разной степени злокачественности. Они подразделяются на большие группы в зависимости от того из каких тканей они развиваются: если из эпителиальных (барьерных) — то это раки, если из соединительных тканей (мягких тканей и костей) – саркомы, если из лимфоидных (иммунных) – лимфомы/лейкозы. От того насколько правильно верифицирована опухоль (определен ее тип, степень злокачественности и другие характеристики) зависит правильность и эффективность лечения. Важную роль в этом играют гистологические исследования.
О том, как проходят гистологические исследования, какие задачи кроме диагностических они позволяют решать, что влияет на сроки их выполнения рассказывает заведующая патологоанатомическим отделением с прозектурой НМИЦ онкологии им. Н.Н. Петрова, к.м.н. Анна Сергеевна Артемьева.
Что служит материалом для патоморфологических (гистологических) исследований?
Процесс получения фрагмента ткани (биоптата) — биопсия – это несколько разных способов забора материала для гистологического исследования.
Биопсию внутренних органов делают под УЗИ-навигацией, либо с помощью хирургического вмешательства.
Как обрабатывают эти материалы для проведения гистологического исследования?
1 Этап. Фиксация — «консервирование» биоптата в формалине — специальном химическом растворе, который предотвращает гниение, позволяет сохранить структуры ткани.
Фиксация биоптата может занимать от 6 до 24 часов – в зависимости от его вида и размера.
Операционный материал фиксируется дольше, в несколько этапов. Сначала предварительная фиксация, которая занимает примерно 12 часов. Затем вырезка нужных фрагментов и повторная фиксация еще 24 часа.
Соотношение объема материала к объему формалина должно быть 1:20.
2 Этап. Процессинг — процесс обезвоживания, обезжиривания и пропитки материала парафином. Автомат перемещает кусочек материала из раствора в раствор.
В качестве растворов применяются: абсолютированный изопропиловый спирт (6-8 смен), ксилол (2 смены), расплавленный парафин (2 смены).
Программа разнится для «жирного» материала (к которым относятся, например, ткани молочной железы) и «нежирного» – 36 и 24 часа соответственно.
Процесс получения парафиновых блоков.
3 Этап. Изготовление парафинового блока. Кусок материала помещается в форму с расплавленным парафином (уже другим нежели во время процессинга – с более высокой температурой плавления) и охлаждается. Выполняется вручную, сложно ускорить.
4 Этап. Изготовление срезов. Толщина образца — кусочка ткани, залитого в парафин – 1-3 мм. Толщина каждого среза 4-5 мкм (0,004-0,005 мм). Выполняет лаборант с использованием специального инструмента – микротома.
Срезы монтируются на стекла и должны высохнуть.
Несмотря на то, что часть материала теряется при выравнивании в микротоме, при должном профессионализме, из одного образца — материала от одной биопсии, операционного материала от одной опухоли, возможно изготовить около 100 стекол (микропрепаратов).
Для чего делаются срезы?
Срезы делаются для рутинной окраски гематоксилинном и эозином, иммуногистохимического исследования и других видов исследований.
Срезы для всех исследований используются одинаковые, различается окраска, могут отличаться стекла, на которые они монтируются, так для ИГХ и FISH нужны специальные адгезивные стекла или заряженные стекла.
Блоки и стекла способны храниться долгие годы и использоваться для проведения дополнительных гистологических исследований, пересмотров, а также в научных целях.
Архив гистологических материалов собирается в НМИЦ онкологии им. Н.Н. Петрова с 1927 года и содержит более 10 млн единиц хранения (микропрепараты — стекла, парафиновые блоки, архивные карточки, влажный архив).
Какие виды гистологических исследований наиболее информативны?
Что позволяют определить разные виды гистологических исследований
Гистологическое исследование – что это такое?
Позволяет верифицировать опухоль – то есть определить из каких клеток она состоит (из какой ткани она развивается), степень ее дифференцировки (зрелости).
Рутинная окраска, выполняющаяся при гистологическом исследовании, позволяет выявить патологический процесс в анализируемом материале (биоптате, операционном материале):
Также, в большинстве случаев, благодаря рутинной окраске, можно определить степень злокачественности опухоли и, если она достаточно зрелая, то какова ее природа.
Окрашенные срезы под микроскопом
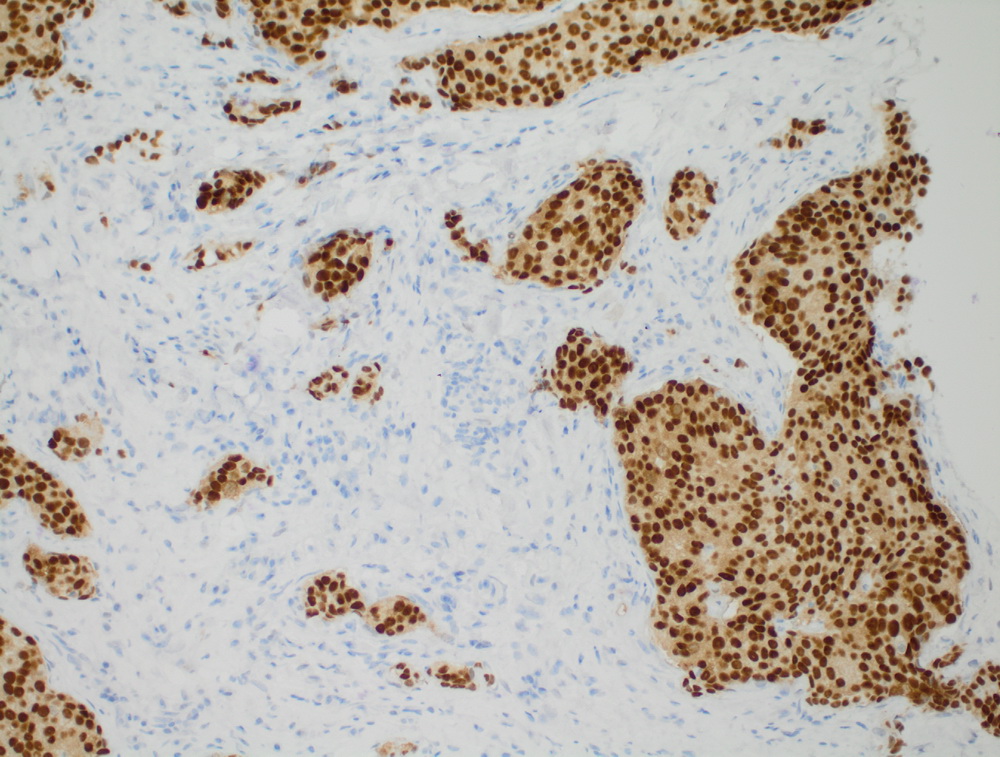 |
Инвазивный протоковый рак er 100%.
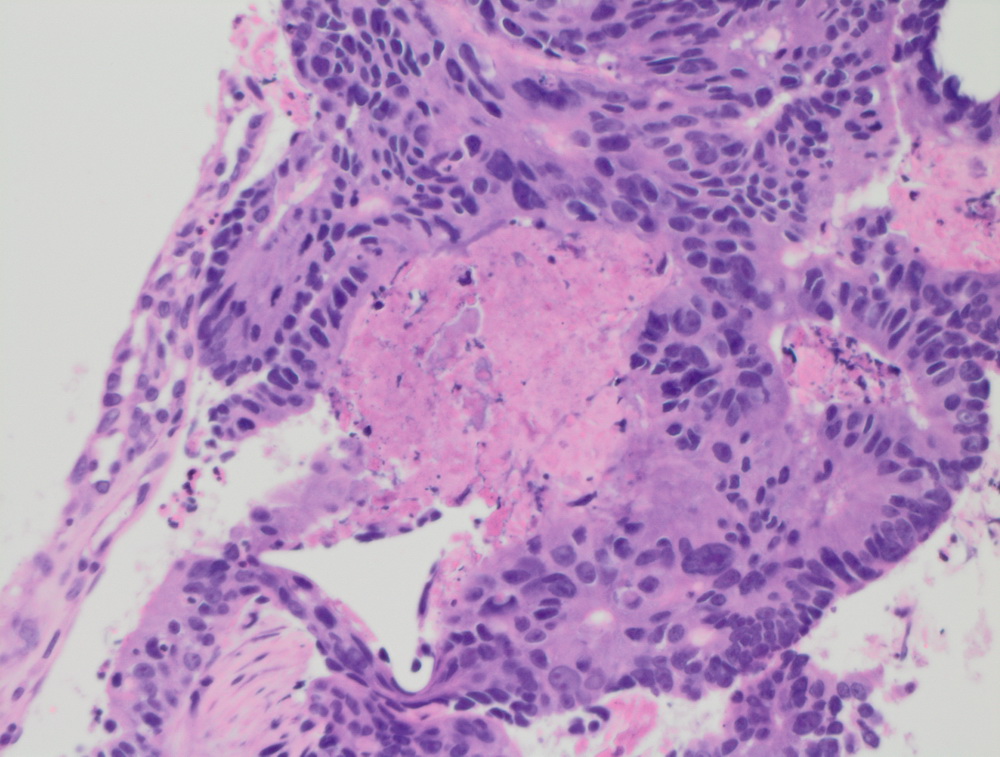
Карцинома сигмовидной кишки.
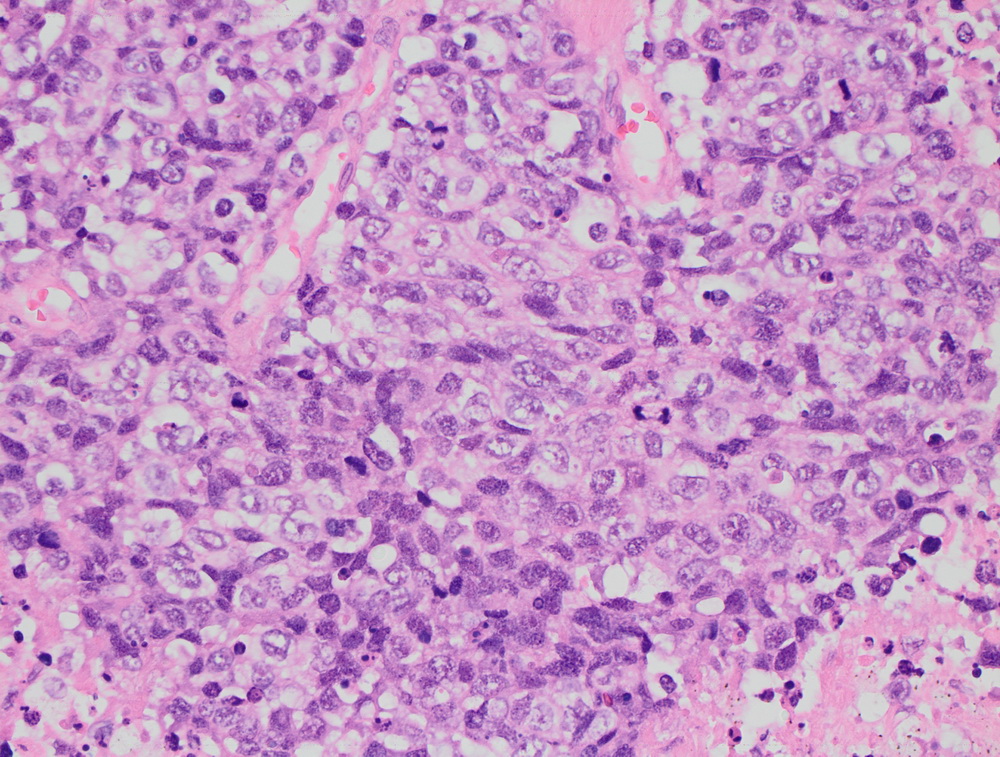
Крупноклеточная нейроэндокринная опухоль.
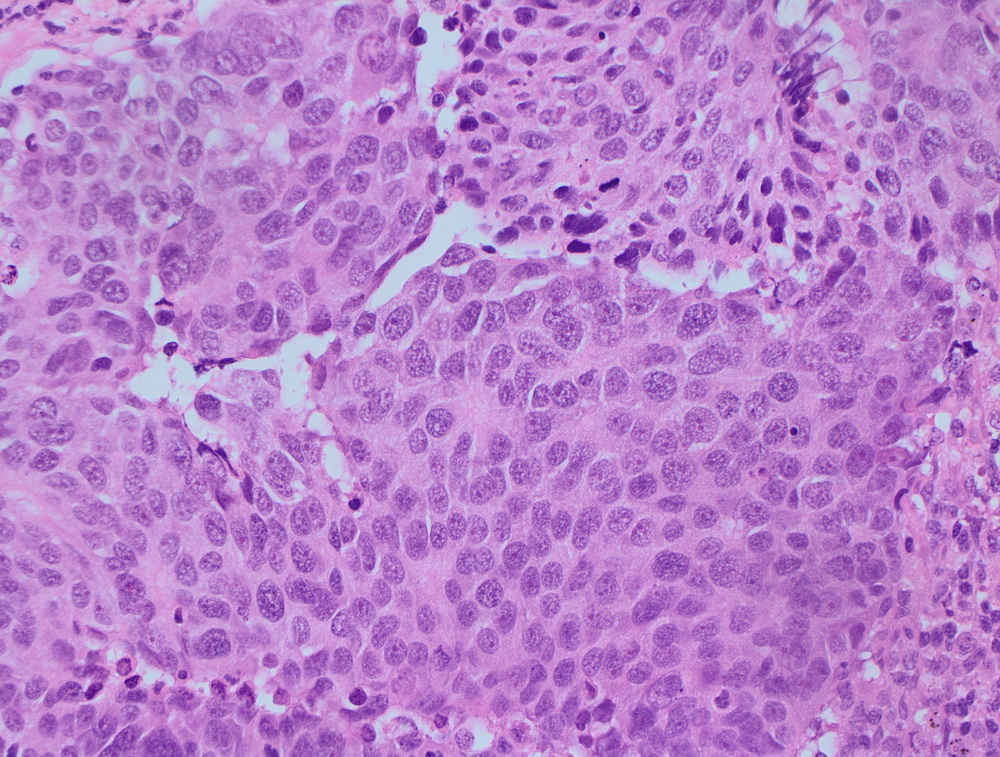
МТС крупноклеточной нейроэндокринной опухоли.
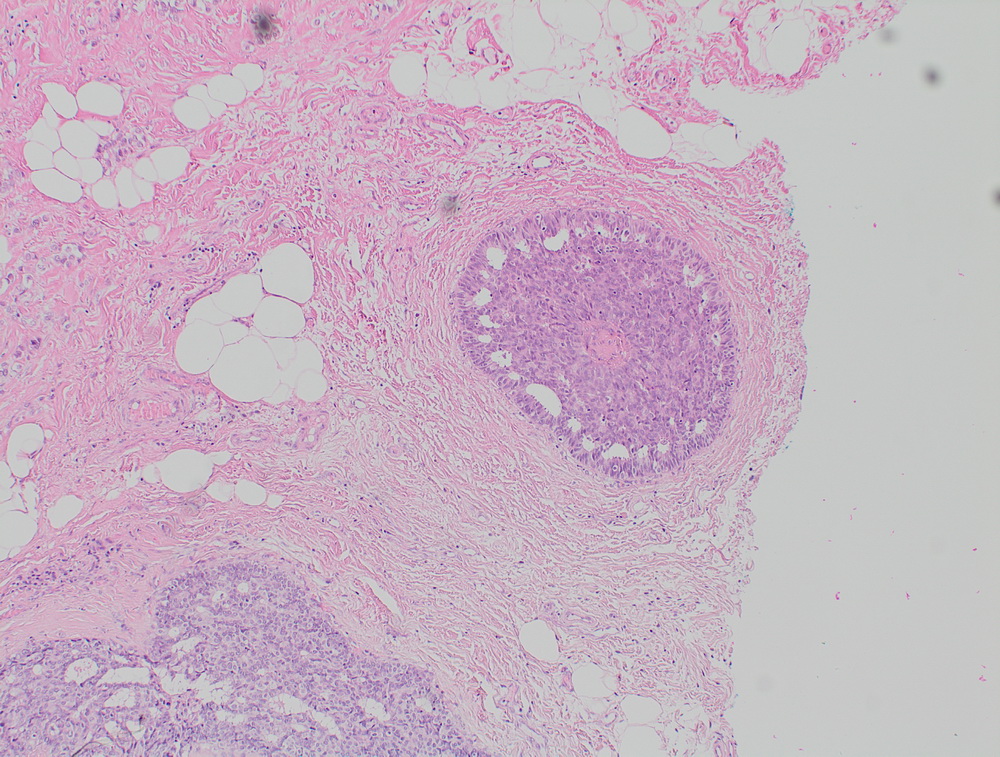
Неспецифический рак молочной железы. Участок in situ карциномы внутри протока, криброзного типа.
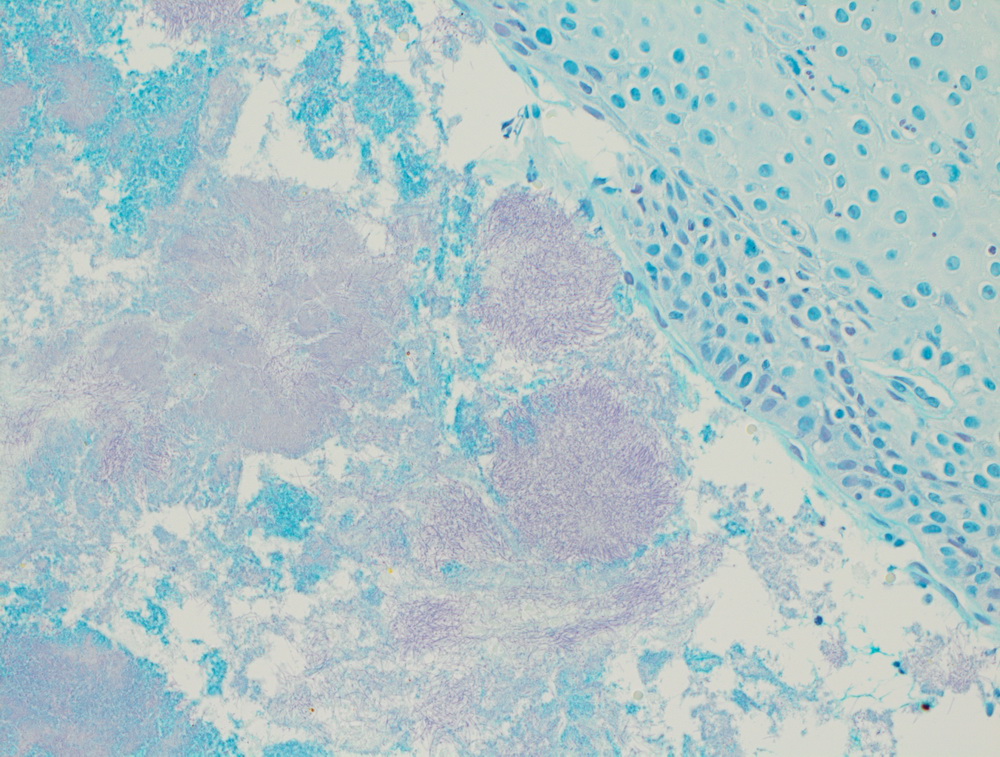
Низкодифферинцированный рак пищевода.
При гистологическом исследовании биоптата и операционного материала можно оценить распространенность: размер опухоли и прорастание в окружающие ткани, насколько затронуты лимфоузлы и есть ли метастазы в отдаленные органы (если эти все структуры присланы для гистологического исследования). При консультации готовых микропрепаратов – стекол, это, как правило, невозможно, если опухоль больше размеров гистологической кассеты или рассечена предыдущим исследователем и не предоставлены данные макроскопического исследования.
Во время гистологического исследования изучаются все стекла от одного образца – материала, полученного от одного вмешательства — одной операции или одной биопсии, вне зависимости от их количества, это считается одной консультацией.
Сроки выполнения гистологического исследования зависят от количества микропрепаратов и от категории сложности того процесса, который в них обнаруживается, сроки могут удлиняться, особенно при необходимости использования дополнительных методов исследования и анализа дополнительных сведений. На сроки выполнения гистологического исследования влияет полнота предоставленной пациентом клинической информации, в том числе данных уже проведенных исследований.
Иммуногистохимия (ИГХ)
Сложное многоэтапное исследование, выполняется после гистологического исследования на том же материале. Опухолевые срезы окрашиваются антителами, которые способны связываться антигенами (белками), которые несут опухолевые клетки. Разные опухолевые клетки несут разные антигены, к каждому из которых подобно ключа к замку подходит антитело.
Один из этапов ИГХ
ИГХ исследование — это комбинаторика. 100% специфичных и чувствительных к какой-то опухоли маркеров не существует, но есть набор антигенов, которые в определенном типе опухоль должны быть и набор тех, которых там быть не должно, таким образом ИГХ-панель строится так чтобы включать несколько антител, которые должны быть позитивны и несколько, которые должны быть негативны. Для разных опухолей различаются эти наборы позитивных/негативных маркеров.
При проведении прогностической ИГХ – выявлении маркеров чувствительности к терапии определяется набор таких маркеров для конкретных опухолей, например, рака молочной железы: рецепторы стероидных гормонов (эстроген, прогестерон), рецептор эпидермального фактора роста (HER2) и индекс пролиферативной активности Ki67 (скорости деления клеток).
Стекла окрашиваются последовательно — различными антителами красятся наборы маркеров в несколько этапов, процесс окраски стекол одним антителом занимает 48 часов.
Таким образом, каждое антитело наносится на отдельный срез ткани, монтированный на отдельное стекло, как правило с соответствующим внешним контролем, количество реакций (используемых антител) и этапов окраски может существенно варьировать в зависимости от конкретной диагностической ситуации, все зависит от индивидуальных особенностей опухоли. Проводится такое количество окрасок, которое необходимо для того, чтобы выявить наиболее характерный для определенной опухоли набор позитивных и негативных маркеров.
Кому-то для этого будет достаточно 5 антител, а кому-то необходимо сделать 20 окрасок и более. Максимальное количество окрасок, которое нам приходилось делать – 212.
Поэтому точные сроки и стоимость этого исследования невозможно определить заранее. Разные по течению и прогнозу опухоли могут быть очень похожи друг на друга, только минимальные различия в окрашивании, с учетом клинических данных и данных других методов обследования, могут позволить установить верный диагноз.
Есть целый ряд доброкачественных опухолей, симулирующих злокачественные, в том числе высокоагрессивные, а некоторые злокачественные высоко дифференцированные опухоли трудно отличить от воспалительных и реактивных процессов. В таких ситуациях только опыт и квалификация патоморфолога, анализ всего комплекса доступной информации (снимки КТ, МРТ, рентген, протокол операции, и др.) позволяют поставить диагноз.
В грамотной интерпретации результатов ИГХ очень важна роль эксперта, ведь те случаи, с которыми приходится работать, в большинстве своем, сложные. Практически не существует антител, которые могут выступать в качестве 100%-х маркеров той или иной опухоли, врачу всегда приходится взвешивать различные вероятности.
Что определяется с помощью ИГХ?
Иммуногистохимия позволяет оценить потенциальный темп роста опухоли, ответ на химио-, таргетную, гормональную терапию.
Флуоресцентная гибридизация in situ (FISH-тест)
Это метод молекулярно-генетической диагностики в ткани.
FISH проводится в срезе ткани и позволяет привязать генетическую перестройку к конкретной опухолевой клетке.
В этом тесте также используются специальные красители, которые связываются только с определенными участками хромосом. Их называют зондами, которые могут быть помечены флуоресцентным или хромогенным красителем, визуализирующимися при помощи флуоресцентного или светового микроскопа.
Технические операции по подготовке гистологических стекол к этому исследованию занимает 2 рабочих дня.
Анализ препарата с помощью многоголового микроскопа.
Полученные микропрепараты очень чувствительны к внешней среде – они могут выцвести со временем, чтобы избежать потерь информации все FISH-препараты сканируются, создается их цифровая копия, которая доступна для внешнего пересмотра. Специалисты просматривают флуоресцирующий материал в темном поле, в анализе препарата принимают участие как минимум 2 специалиста. При необходимости используется и цифровой анализ.
Что определяется с помощью FISH-теста?
FISH-тест позволят диагностировать некоторые виды опухолей, определяет целесообразность использования некоторых химиотерапевтических препаратов.
Проведение гистологического исследования, и в первую очередь FISH-теста — это экспертная работа, которая зависит от квалификации специалиста. Очень многие мутации, которые выявляются в опухолях, не всегда являются метками опухолей, они могут находиться и в доброкачественных образованиях или нормальных тканях.
За год патологоанатомическое отделение НМИЦ онкологии имени Н.Н. Петрова выполняет около 20000 гистологических исследований (пациентов), из них около 5000 консультативных случаев (пересмотров), более 30000 ИГХ исследований, а также участвует в программе внешнего контроля качества ИГХ исследований NordIQ.
Специалисты отделения обладают огромным опытом проведения гистологических исследований и экспертными компетенциями.
Скорость выполнения гистологических исследований и адекватность гистологического заключения зависят от ряда факторов:
После выполнения гистологического исследования пациент получает гистологическое заключение/протокол исследования гистологического материала.
Расшифровка гистологического исследования: на что обратить внимание?
Гистологическое заключение включает в себя несколько рубрик (полей):
Макроскопическое описание
Заполняется как для биоптатов — не обязательно, так и для операционного материала, для которого имеет крайне важное значение в ряде случаев.
Микроскопическое описание
Описание изменений на микроскопическом уровне, не обязательно к заполнению, так как вся необходимая информация может быть отражена в поле «заключение».
Результаты иммуногистохимического исследования
В этом поле описано какие антитела использовались в данном случае и каков результат окрашивания: наличие окрашивание или его отсутствие, локализация в клетке при необходимости, а также процент позитивных клеток и интенсивность реакции, когда это имеет значение.
Патологоанатомическое заключение
Содержит нозологическую/классификационную единицу, если ее возможно установить по исследованному материалу, то есть дает ответы на вопросы:
Также приводятся все необходимые прогностические данные: степень дифференцировки, параметры, влияющие на стадию, состояние краев резекции, если возможно их оценить и т.п.
Дополнительные замечания и рекомендации
Поле может содержать комментарии, относительно возможного направления дальнейшего обследования, вероятности того или иного диагноза, необходимости ознакомиться с теми или иными клиническими данными и др.
Мы не рекомендуем пациентам самостоятельно заниматься расшифровкой показателей гистологического исследования, используя информацию, полученную на различных Интернет-сайтах и форумах пациентов, так как на интерпретацию данных влияет большое количество факторов, в том числе, возраст пациента, данные других исследований и др.
Расшифровкой исследования может заниматься только специалист – врач онколог по профилю заболевания!
Авторская публикация:
АРТЕМЬЕВА АННА СЕРГЕЕВНА
заведующий патологоанатомического отделения с прозектурой ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, кандидат медицинских наук