Сцинтиграфия и пэт кт в чем разница
Однофотонная эмиссионная компьютерная томография
Отличие ОФЭКТ от КТ
КТ является методом структурной визуализации ткани. Она позволяет четко определить локализацию патологического процесса, размер участка поражения, его форму, степень вовлечения окружающих тканей и др. ОФЭКТ в свою очередь основана на способности тканей в разной степени накапливать в себе специальные радионуклидные препараты за счет различного кровоснабжения в них. Так, очаги воспаления, опухоли и метастазы в большей степени накапливают в своих тканях введенный внутривенно радиофармпрепарат, что фиксируется аппаратом гамма-камеры и позволяет получить послойные изображения накопления препарата. Однако отдельно метод ОФЭКТ не обладал высокой диагностической ценностью из-за бедности пространственного разрешения, которое не позволяло точно указать локализацию обнаруженного очага накопления. Поэтому были созданы аппараты ОФЭКТ-КТ, которые совмещают в себе достоинства обоих методов и позволяют установить четкие границы органов одновременно исследуя степень накопления препарата в них.
Отличие ОФЭКТ от ПЭТ
ПЭТ отличается от ОФЭКТ тем, что для ее проведения необходимы радиофармпрепараты, содержащие радиоактивные изотопы, которые способны излучать гамма-кванты с энергией более 1024 кэВ. Возможность применения различных изотопов позволяет определять процесс, тропный именно для исследуемой ткани или для определенного онкопроцеса. При взаимодействии с тканями организма, каждый первичный квант создает при этом две частицы: электрон и позитрон. В дальнейшем это приводит к одновременному образованию двух гамма-квантов, вылетающих в противоположные стороны. Этот физико-химический процесс обеспечивает уникальные диагностические возможности ПЭТ.
В свою очередь при ОФЭКТ после инъекции радионуклида стандартная гамма-камера захватывает лишь по одному кванту, выходящему из тела. Отсутствие надобности применения изотопных радиофармпрепаратов делает цену на ОФЭКТ значительно доступнее таковой при ПЭТ, а методику более распространенной.
Показания:
Противопоказания:
Как проходит процедура ОФЭКТ-КТ?
Звоните нам по телефону 8 (812) 407-29-86 с 7:00 до 00:00 или оставьте заявку на сайте в любое удобное время
Сцинтиграфия и пэт кт в чем разница
Томография основана на получении послойных изображений объекта исследований. Впервые этот метод был разработан Н.И. Пироговым. Он создал атлас под названием «Топографическая анатомия», содержащий изображения послойных разрезов, проведённых через замороженное тело человека в трёх направлениях. Современная томография также основана на получении послойных изображений. Однако, современная томография позволяет проводить прижизненные исследования и с помощью математической обработки производить трехмерную реконструкцию изображения исследуемого органа.
В медицине используется различные методы томографии: Компьютерная томография (КТ), Магниторезонансная томография (МРТ), Однофотонная эмиссионная компьютерная томография (ОЭФКТ) и Позитронная эмиссионная томография (ПЭТ).
Компьютерная томография
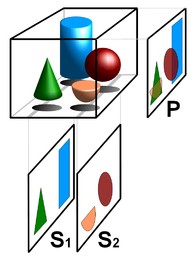 Рис. 1. Иллюстрация различия обычной рентгенограммой и послойным изображением |
Компьютерная томография — метод неразрушающего послойного исследования внутреннего строения был предложен в 1979 году Годфри Хаунсфилдом и Алланом Кормаком, удостоенных за эту разработку Нобелевской премии.
У обычных рентгеновских методов есть недостатки. Во-первых, в двумерной рентгеновской картине объекты расположены в глубине накладываться (см. рис.1). Во-вторых, обычно рентгеновские лучи не могут различать мягкие ткани. Изменения в мягких тканях, таких как печень и поджелудочная железа, не различимы, а некоторые другие органы могут быть сделаны видимыми только посредством использования рентгеноконтрастных красителей. В-третьих, при использовании обычных рентгеновских методов, не представляется возможным количественно измерить плотности отдельных веществ, через которые прошло рентгеновское излучение. Радиограмма фиксирует только среднее поглощение всех различных тканей. Компьютерная томография измеряет ослабление рентгеновских лучей, проходящих через участки тела из сотен различных углов, получая срезы, а затем, с помощью компьютерной обработки, большой серии двумерных рентгенографических снимков, сделанных вокруг одной оси вращения, получается трехмерное изображение.
Прогресс КТ-томографов напрямую связан с увеличением количества детекторов, то есть с увеличением числа одновременно собираемых проекций.
Аппарат 1-го поколения появился в 1973 году. КТ-аппараты первого поколения были пошаговыми. Была одна трубка, направленная на один детектор. Сканирование производилось шаг за шагом, делая по одному обороту на слой. Каждый слой обрабатывался около 4 минут.
| *Гентри — подвижная, как правило кольцевая, часть томографического аппарата, содержащая сканирующее оборудование. |
Дальнейший прогресс связан с появлением
спиральных компьютерных томографов (1988 г.) и увеличением количества детекторов. Спиральное сканирование заключается в непрерывном вращении рентгеновской трубки и непрерывном поступательного движения стола с пациентом вдоль продольной оси сканирования z через апертуру гентри*. Технология спирального сканирования позволила значительно сократить время, затрачиваемое на КТ-исследование и существенно уменьшить лучевую нагрузку на пациента.
 Рис.2. Современный компьютерный томограф |
В 1992 г. появились первые мультисрезовые компьютерные томографы (МСКТ). В них по окружности гентри расположены не один, а два и более ряда детекторов. К 2013 г. количество срезов было доведено до 512 и 640. Для того, чтобы рентгеновское излучение могло одновременно приниматься детекторами, расположенными на разных рядах, была разработана новая — объёмная геометрическая форма пучка. Стали производиться томографы с двумя рентгеновскими трубками, расположенными под углом 90°, что позволило еще уменьшить временное разрешение.
Современные томографы позволяют не только получать изображения, но и дают возможность практически в «реальном» времени наблюдать физиологические процессы, происходящие в головном мозге и в сердце. Они дают возможность сканирования целого органа (сердце, суставы, головной мозг и т. д.) за один оборот рентгеновской трубки, что значительно сокращает время обследования, а также дает возможность для сканирования сердца даже у пациентов, страдающих аритмиями.
Сцинтиграфия и однофотонная эмиссионная компьютерная томография
Сцинтиграфия
Сцинтиграфия — метод функциональной визуализации, заключающийся во введении в организм радиоактивных изотопов и получении двумерного изображения путём определения испускаемого ими излучения.
| * Иногда в качестве меток (меченных атомов применяют стабильные изотопы, которые фиксируются масс-спектрометрами. |
Пациенту вводят препарат, состоящий из молекулы-вектора и радионуклида*. Молекула-вектор поглощается определённой структурой организма (орган, ткань, жидкость). Радионуклид излучает, и его излучение регистрируется детектором (гамма-камерой).
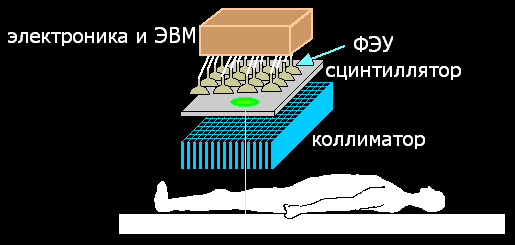 Рис. 3. Схема гамма-камеры. |
В состав современной гамма-камеры входят (см. рис. 3)
Чтобы получить информацию о направлении вылета из человеческого тела γ-квантов, происходит их коллимация в многоканальном коллиматоре. Сцинтиллятор детектора просматривается матрицей фотоумножителей. Таким образом определяется направление прихода γ-кванта, что дает возможность реконструировать точку его испускания.
Однофотонная эмиссионная компьютерная томография
(Single-photon emission computed tomography, SPECT)
 Рис. 4. Однофотонный эмиссионный компьютерный томограф. |
Дальнейшее развитие радиоизотопной диагностики привело к созданию однофотонных эмиссионных компьютерных томографов (ОФЭКТ). В этих томографах трехмерное изображение получается путём компьютерной обработки серии плоскостных сцинтиграмм.
Для того, чтобы получить изображения в ОФЭКТ, гамма-камера поворачивается вокруг пациента. Проекции фиксируются, как правило, через каждые 3-6 градусов. В большинстве случаев для получения оптимального восстановления, используется полное вращение на 360 градусов. Типичное время, необходимое для получения каждой проекции 15-20 секунд. Соответственно общее время сканирования 15-20 минут. Для уменьшения времени сканирования используются детектирующие системы состоящие из двух или более гамма-камер.
Использование электрокардиографа в качества триггера в ОФЭКТ позволяет получить дифференциальную информацию о работе сердца в различные моменты сердечного цикла.
В сцинтиграфии и ОФЭКТ используются одни и те же радиоактивные препараты. В большинстве диагностических процедур (
80%) в течение последних 30 лет используются препараты с 99m Tc. Однако используют и другие радиоизотопы. В таблице приведены некоторые изотопы, используемые в диагностике
| Изотоп | T1/2 | Орган |
|---|---|---|
| 201 Tl | 73 ч | сердце |
| 99m Тс | 6 ч | сердце, легкие, почки, кости, костный мозг |
| 67 Ga | 78 ч | сердце |
| 131 I | 8 дн | лёгкие, головной мозг, почки, печень, щитовидная железа и др |
| 189 Au | 28.7 м | печень, лимфоузлы |
| 111 In | 2.8 дн | печень |
Так для сцинтиграфии сердца используют 201 Tl, пирофосфат 99m Тс, 67 Ga. Галлий, например, накапливается в воспалительных очагах в сердце, что проявляется на сцинтиграммах. При сцинтиграфии легких: с помощью альбумина, меченного 131 I или 99m Тс, на сцинтиграммах обнаруживают зоны значительного уменьшения накопления изотопа, что свидетельствует о тромбоэмболии легочной артерии. Изображение костного мозга можно получить с помощью серного коллоида, меченного технецием 99m Тс, который накапливается в клеточных элементах костного мозга. При острых лейкозах, у больных миелосклерозом, при лимфогранулематозе в изображениях костного мозга имеются особенности. Сцинтиграфия щитовидной железы проводится с помощью препаратов 131 I или 99m Тс, что позволяет диагностировать в ней узловые образования.
КТ + ОФЭКТ
Объединение компьютерной томографии и однофотонной эмиссионной компьютерной томографии в единой системе приводит к повышению точности обоих типов исследования. Так ослабление гамма-излучения, внутри пациента может привести к существенной недооценке активности в глубоких тканях, по сравнению с поверхностными тканями. Использование интегрированного с ОФЭКТ компьютерного томографа позволяет оптимизировать коррекцию поглощения гамма-излучения в тканях. Интегрированная система позволяет точно определить локализацию поражения при наложении изображения, проводить своевременную диагностику онкологических заболеваний, осуществлять дифференциацию злокачественных и доброкачественных образований различных органов и систем, выявлять наличие структурных изменений и функциональных нарушений на стадии минимальных клинических проявлений заболевания.
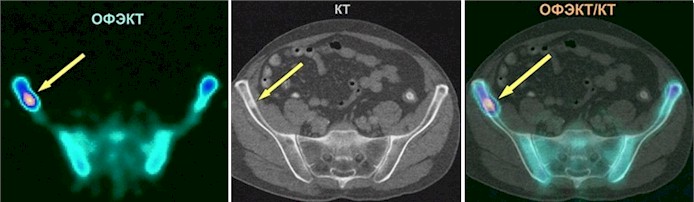
Рис. 5. Изображения в ОФЭКТ, КТ и интегрированной системе ОФЭКТ/КТ
Позитронно-эмиссионная томография
(Двухфотонная эмиссионная томография)
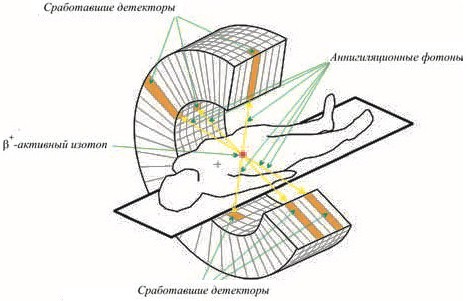
Рис. 6. Схематическое изображение ПЭТ.
ПЭТ все чаще используется вместе с КТ или магнитно-резонансной томографией (МРТ). Таким образом практически одновременно получается информация как о структуре, так и о биохимии. ПЭТ наиболее полезна в сочетании с анатомической визуализацией. Современные ПЭТ-сканеры теперь доступны с интегрированными КТ-сканерами, размещенными в одном гантри (ПЭТ-КТ). Два сканирования могут быть выполнены последовательно в течение одного сеанса. Больной не изменяет положение между двумя типами сканирования. Таким образом, функциональная визуализация, получаемая с помощью ПЭТ, который изображает пространственное распределение метаболических или биохимической активности в организме, может быть скоррелировано с анатомической визуализациуй полученной с помощью КТ. ПЭТ-КТ добавляет точность анатомической локализации в функциональную визуализацию, которой ранее не хватало у обычной ПЭТ.
Новые установки ПЭТ состоят почти исключительно из комбинированных сканеров ПЭТ-КТ. Однако, ПЭТ-КТ имеет определенные недостатки, в том числе невозможность одновременно осуществлять сбор данных и значительного дозы облучения пациента, внесенной КТ.
В последнее время активно ведутся работы по альтернативной ПЭТ-КТ гибридной технологии визуализации – технологии ПЭТ-МРТ. По сравнению с КТ МРТ, в частности, дает лучший контраст между мягкими тканями. Вообще, комбинация ПЭТ-МРТ обеспечивает много преимуществ, которые выходят за рамки простого сочетания функциональной информации от ПЭТ с структурной информацией от МРТ. Области клинического применения ПЭТ-МРТ онкология, кардиология и неврология.
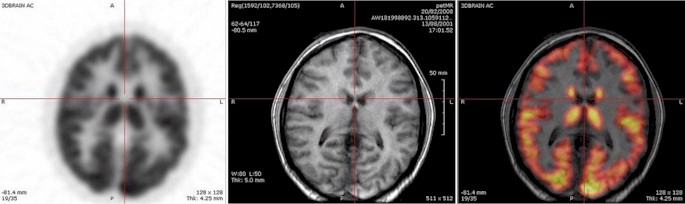
Рис. 7. Снимки экрана компьютера. Слева направо изображения ПЭТ, МРТ и комбинированное изображение ПЭТ-МРТ.
Изотопы для ПЭТ, как правило, вырабатывают на месте проведения исследования. Это связано с тем, что большинство ПЭТ- изотопов являются ультракороткоживущими, с периодами полураспада которые исчисляется несколькими минутами и даже секундами. Ускорители производящие необходимые для ПЭТ часто располагаются вблизи томографа, либо являются составной части комплекса. Поскольку для получения позитронных эмиттеров достаточно иметь протоны с энергией от 10-18 МэВ или дейтроны с энергией 5-9 МэВ (для этой цели подходят малогабаритные циклотроны). Часто томографы поставляются вместе с циклотроном. Кроме того необходима автоматическая радиохимическая лаборатория.
Альтернатива такой организации ПЭТ в ряде случаев − генератор радионуклидов.
ОФЭКТ-КТ исследование в онкологии
Как проходит исследование? Пациенту внутривенно вводят радиоактивный препарат, и врач через определенное время с помощью современного оборудования (ОФЭКТ-КТ или ПЭТ-КТ) видит его пространственное распределение в клетках, тканях или органах у обследуемого человека. С помощью современных компьютерных систем формируется изображение, которое анализируют обычно не менее 2 специалистов.

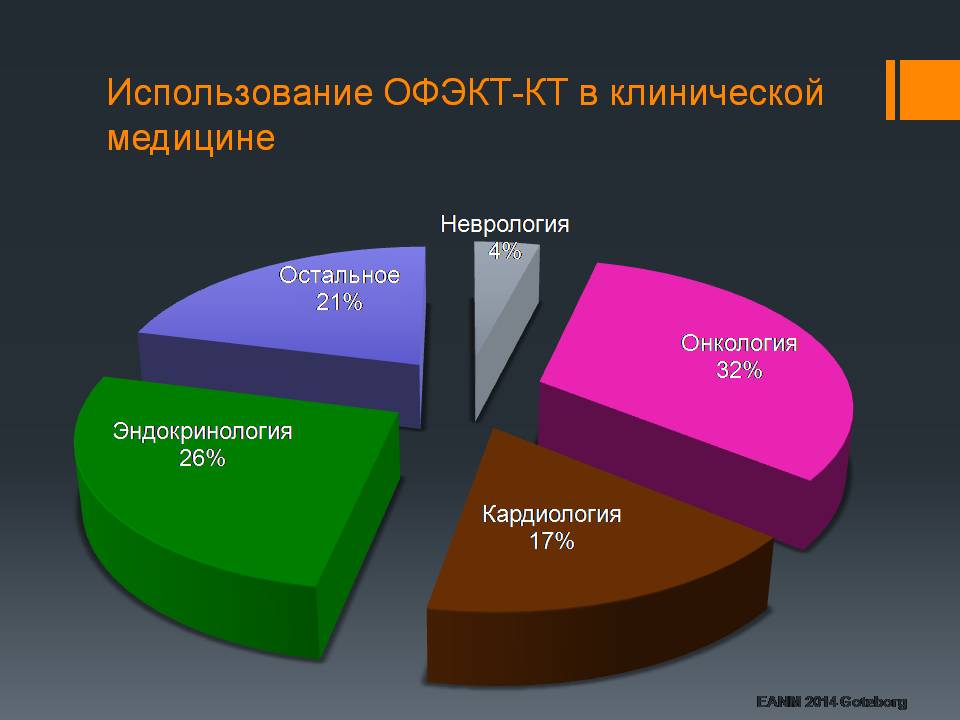
По данным Европейского общества ядерной медицины, треть всех ОФЭКТ-КТ исследований производится в онкологии.
С помощью ОФЭКТ-КТ исследования мы можем определить аномально протекающие биохимические процессы в опухолевых клетках, когда анатомические и морфологические изменения еще не видны и не могут быть выявлены с помощью методов классической лучевой диагностики, таких, как рентгенография или КТ. С помощью методов радионуклидной диагностики сегодня мы можем диагностировать опухоли размерами менее 1 сантиметра.
Главная задача радионуклидных исследований в онкологии – оценка распространенности опухолевого процесса и оценка эффективности лечения.
Основные методы лучевой и радионуклидной диагностики разделяют на две категории
Гибридные методы сочетают в себе анатомические и функциональные. К ним относится ОФЭКТ-КТ и ПЭТ-КТ. В отделении радионуклидной диагностики НМИЦ онкологии им. Н.Н. Петрова установлен гибридный аппарат «SiemensSymbiaT16». Этот прибор сочетает в себе двухдетекторную гамма-камеру и 16-срезовый компьютерный томограф. В целом информативность ОФЭКТ-КТ выше, чем КТ + ОФЭКТ отдельно. Исследования достаточно безопасны для пациентов.
За одно обследование получается максимум диагностической информации. Например, при раке молочной железы на ОФЭКТ-КТ томографе Siemens за одно исследование мы можем оценить состояние молочной железы, регионарных лимфатических узлов, органов грудной и брюшной полостей. В результате, пациент может начать специфическое противоопухолевое лечение максимально быстро.
Преимущества ОФЭКТ-КТ
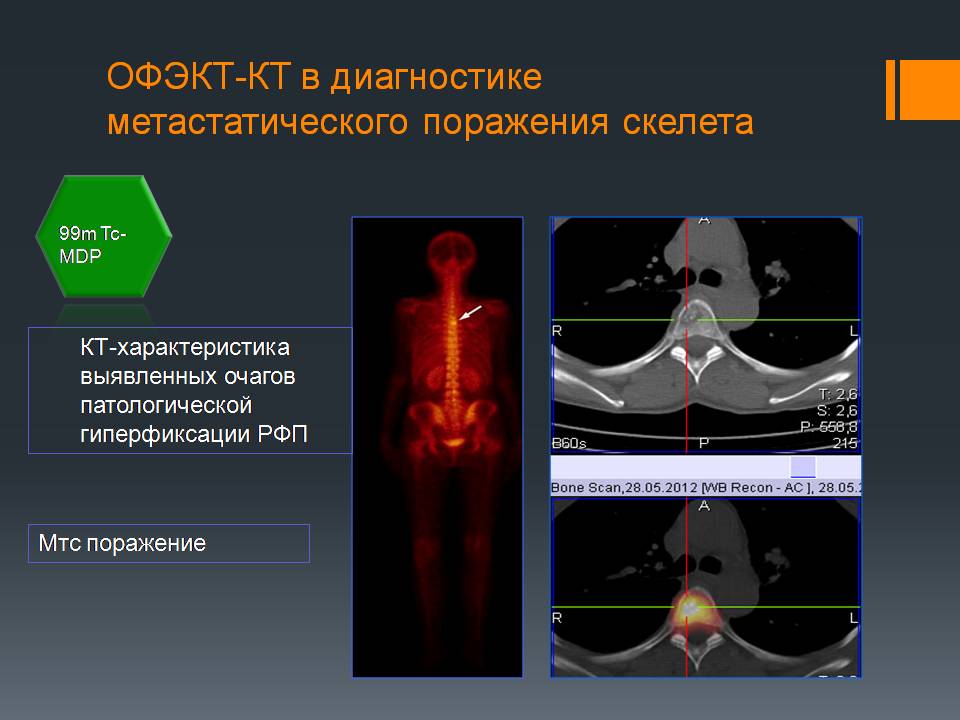
Диагностика метастатического поражения скелета
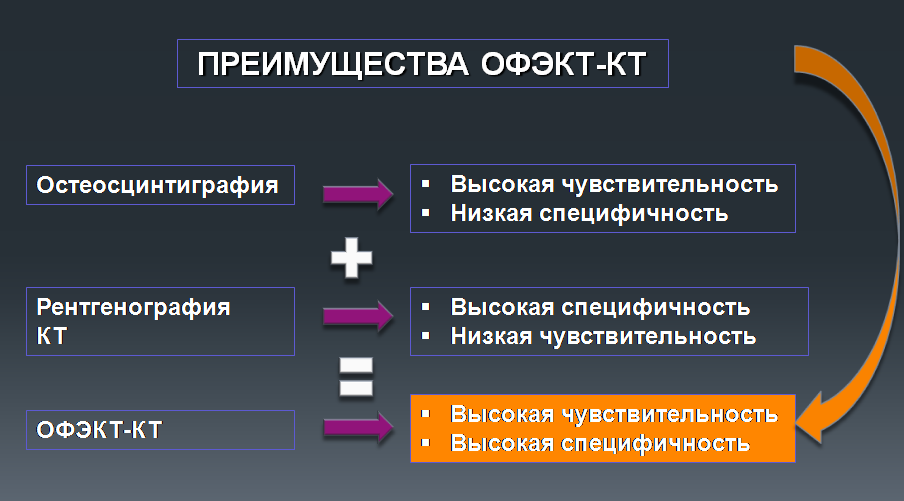
Наибольшее распространение этот метод получил в исследовании костей. ОФЭКТ-КТ исследование объединяет преимущества остеосцинтиграфии – высокую чувствительность и рентгенографии – высокую специфичность.
В результате ОФЭКТ-КТдиагностики могут быть выявлены новые уточняющие данные и даже может измениться диагноз. По опыту отделения радионуклидной диагностики НМИЦ онкологии им. Н.Н. Петрова: после рутинной остеосцинтиграфии в 40% случаев изменялся диагноз.
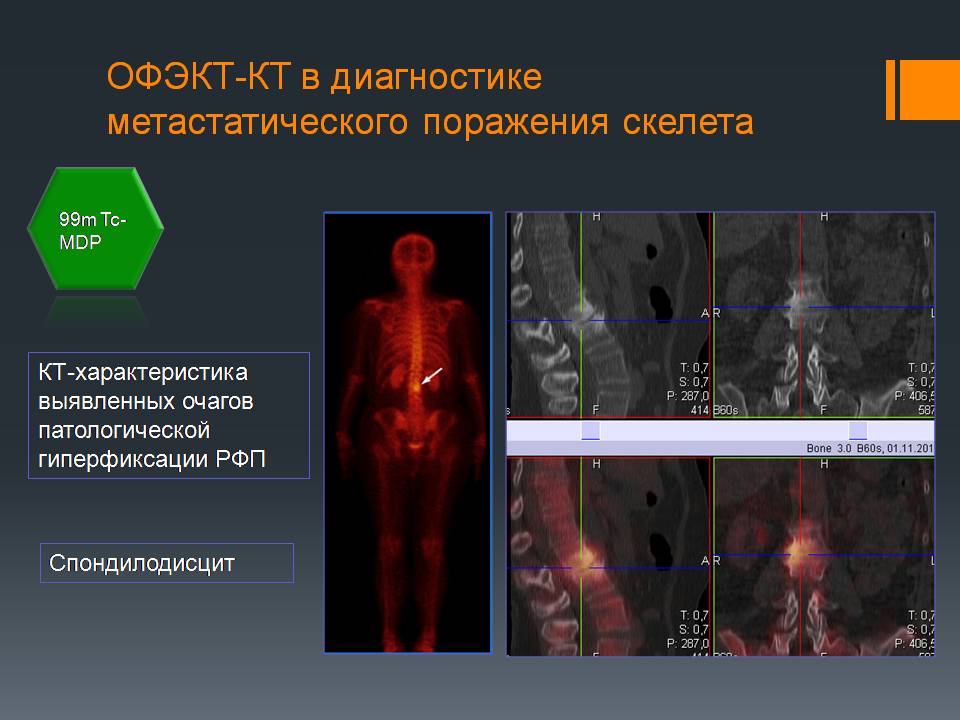
Пример уточняющей диагностики: При КТ-исследовании выявлен очаг, подозрительный на метастазы в 3 поясничном позвонке. После выполнения ОФЭКТ-КТ видно, что это спондилодисцит позвоночника, не онкологическое заболевание.
Пример уточняющей диагностики: Выявлен очаг гиперфиксации подозрительный на мтс. На снимке ОФЭКТ-КТ подтверждается, что это метастазы.
Диагностика метастатического поражения регионарных лимфоузлов у больных РМЖ
Статус регионарных лимфатических узлов влияет не только на прогноз, но и на выбор лечебной тактики, на объем лучевой терапии. При поражении лимфоузлов лучевая терапия может проводиться в над- и подключичной области. А при отсутствии метастазов облучается только грудная стенка и даже возможно полное отсутствие лучевой терапии.
Биопсия сигнальных лимфоузлов у больных РМЖ
Современное лечение РМЖ немыслимо без методов радионуклидной диаг ностики. Известно, что состояние сигнального лимфоузла определяет состояние всех остальных лимфоузлов. При помощи ОФЭКТ-КТ можно анатомически точно определить сигнальный лимфоузел. Во-первых, это помощь для хирурга: точная локализация позволяет ему быстрее обнаружить нужный лимфоузел. Во-вторых, результат исследования облегчает навигацию при последующей лучевой терапии.
ОФЭКТ-КТ также успешно применяется в диагностике нейроэндокринных новообразований, в диагностике метастазов при раке предстательной железы.
Авторская публикация:
Крживицкий Павел Иванович
врач-рентгенолог, врач-радиолог, кандидат медицинских наук.
Заведующий отделением радионуклидной диагностики, cтарший научный сотрудник отдела ядерной медицины и радиационной онкологии
Идём на обследование: плюсы и минусы радиоизотопной диагностики
Сплошные преимущества
В основе этого метода обследования лежит способность радиоактивных изотопов к излучению. Сейчас чаще всего проводят компьютерное радиоизотопное исследование – сцинтиграфию. Вначале пациенту в вену, в рот или ингаляционно вводят радиоактивное вещество. Чаще всего используются соединения короткоживущего изотопа технеция с различными органическими веществами.
Излучение от изотопов улавливает гамма-камера, которую помещают над исследуемым органом. Это излучение преобразуется и передается на компьютер, на экран которого выводится изображение органа. Современные гамма-камеры позволяют получить и его послойные «срезы». Получается цветная картинка, которая понятна даже непрофессионалам. Исследование проводится в течение 10–30 минут, и все это время изображение на экране меняется. Поэтому врач имеет возможность видеть не только сам орган, но и наблюдать за его работой.
Все другие изотопные исследования постепенно вытесняются сцинтиграфией. Так, сканирование, которое до появления компьютеров было основным методом радиоизотопной диагностики, сегодня применяется все реже. При сканировании изображение органа выводится не на компьютер, а на бумагу в виде цветных заштрихованных строчек. Но при этом методе изображение получается плоским и к тому же дает мало информации о работе органа. Да и больному сканирование доставляет определенные неудобства – оно требует от него полной неподвижности в течение тридцати-сорока минут.
Точно в цель
С появлением сцинтиграфии радиоизотопная диагностика получила вторую жизнь. Это один из немногих методов, который выявляет заболевание на ранней стадии. К примеру, метастазы рака в костях обнаруживаются изотопами на полгода раньше, чем на рентгене. Эти полгода могут стоить человеку жизни.
В некоторых случаях изотопы – вообще единственный метод, который может дать врачу информацию о состоянии больного органа. С их помощью обнаруживают заболевания почек, когда на УЗИ ничего не определяется, диагностируют микроинфаркты сердца, невидимые на ЭКГ и ЭХО-кардиограмме. Порой радиоизотопное исследование позволяет врачу «увидеть» тромбоэмболию легочной артерии, которая не видна на рентгене. Причем этот метод дает информацию не только о форме, строении и структуре органа, но и позволяет оценить его функциональное состояние, что чрезвычайно важно.
Если раньше с помощью изотопов обследовали только почки, печень, желчный пузырь и щитовидную железу, то сейчас положение изменилось. Радиоизотопная диагностика применяется практически во всех областях медицины, включая микрохирургию, нейрохирургию, трансплантологию. К тому же эта диагностическая методика позволяет не только поставить и уточнить диагноз, но и оценить результаты лечения, в том числе вести постоянное наблюдение за послеоперационными больными. К примеру, без сцинтиграфии не обойтись при подготовке больного к аортокоронарному шунтированию. А в дальнейшем она помогает оценить эффективность операции. Изотопы выявляют состояния, угрожающие жизни человека: инфаркт миокарда, инсульт, тромбоэмболию легочной артерии, травматические кровоизлияния в мозг, кровотечения и острые заболевания органов брюшной полости. Радиоизотопная диагностика помогает отличить цирроз от гепатита, разглядеть злокачественную опухоль на первой стадии, выявить признаки отторжения пересаженных органов.
Под контролем
Противопоказаний к радиоизотопному исследованию почти нет. Для его проведения вводится ничтожное количество короткоживущих и быстро покидающих организм изотопов. Количество препарата рассчитывается строго индивидуально в зависимости от веса и роста пациента и от состояния исследуемого органа. А врач обязательно подбирает щадящий режим исследования. И самое главное: облучение при радиоизотопном исследовании обычно даже меньше, чем при рентгенологическом. Радиоизотопное исследование настолько безопасно, что его можно проводить несколько раз в год и сочетать с рентгеном.
На случай непредвиденной поломки или аварии изотопное отделение в любой больнице надежно защищено. Как правило, оно расположено далеко от лечебных отделений – на первом этаже или в подвале. Полы, стены и потолки в нем очень толстые и покрыты специальными материалами. Запас радиоактивных веществ находится глубоко под землей в специальных просвинцованных хранилищах. А приготовление радиоизотопных препаратов производится в вытяжных шкафах со свинцовыми экранами.
Также ведется постоянный радиационный контроль с помощью многочисленных счетчиков. В отделении работает обученный персонал, который не только определяет уровень радиации, но и знает, что предпринять в случае утечки радиоактивных веществ. Кроме сотрудников отделения, уровень радиации контролируют специалисты СЭС, Госатомнадзора, Москомприроды и УВД.
Простота и надежность
Определенных правил во время радиоизотопного исследования должен придерживаться и пациент. Все зависит от того, какой орган предполагается обследовать, а также от возраста и физического состояния больного человека. Так, при исследовании сердца пациент должен быть готов к физическим нагрузкам на велоэргометре или на дорожке для ходьбы. Исследование будет более качественным, если его делать на голодный желудок. Ну и, конечно, нельзя принимать лекарственные препараты за несколько часов до исследования.
Перед сцинтиграфией костей пациенту придется выпить много воды и часто мочиться. Такая промывка поможет вывести из организма изотопы, которые не осели в костях. При исследовании почек тоже надо выпить побольше жидкости. Сцинтиграфию печени и желчных путей делают на голодный желудок. А щитовидная железа, легкие и головной мозг исследуются вообще без всякой подготовки.
Радиоизотопному исследованию могут помешать металлические предметы, оказавшиеся между телом и гамма-камерой. После введения препарата в организм надо подождать, пока тот достигнет нужного органа и распределится в нем. Во время самого исследования пациент не должен двигаться, иначе результат будет искажен.
Простота радиоизотопной диагностики дает возможность обследовать даже крайне тяжелых больных. Ее применяют и у детей, начиная с трех лет, в основном им исследуют почки и кости. Хотя, конечно, дети требуют дополнительной подготовки. Перед процедурой им дают успокаивающее, чтобы во время исследования они не вертелись. А вот беременным радиоизотопное исследование не проводят. Это связано с тем, что развивающийся плод очень чувствителен даже к минимальной радиации.
.e07.jpg)