вторичная структура трнк имеет форму
Строение тРНК
Все тРНК имеют общие черты как в структуре, так и в способе складывания полинуклеотидной цепи во вторичную структуру. На рис. 1 представлены универсальные черты первичной и вторичной структур тРНК.
Особенности строения тРНК органелл
Хлоропласты и митохондрии содержат автономно все компоненты, необходимые для транскрипции и трансляции их генетической информации. ТРНК кодируется геномом органелл.
Изоакцепторные тРНК
В каждой клетке присутствует более 20 видов тРНК. В кишечной палочке 45 видов тРНК. Это значит, что несколько различных тРНК могут соединяться с одной и той же аминокислотой; такие тРНК называются изоакцепторными. Изоакцепторные тРНК могут узнавать кодоны для данной аминокислоты. Если кодируется 4 или более кодонами, то обязательно существуют 2 или более изоакцепторных тРНК с разными антикодонами.
Аминоацилирование тРНК
Например, валил-тРНК-синтетаза катализирует реакцию синтеза валил-тРНК:
V а1 + тРНК. + АТР = V а1-тРНК + АМР + РР, (1)
включающую две стадии.
Е + V а1 + АТР = Е*( V а1-АМР) + РР, (2)
Е*( V а1-АМР) + тРНК = Е + АМР + V а1-тРНК, (3)
Молекулярные основы узнавания тРНК аминоацил-тРНК-синтетазами
1. Антикодон. Участие антикодона, определяющего на рибосоме включение аминокислоты в цепь белка и в отборе этой аминокислоты на стадии реакции аминоацилиравания тРНК.
2. Первые три пары нуклеотидов акцепторного стебля (1-72, 2-71, 3-70). Синтетазой может вовлекаться от одной до трех пар нуклеотидов акцепторного стебля.
ЗАКЛЮЧЕНИЕ
Киселев Л.Л., Лаврик О.И. «Биосинтез белков от аминокислот до аминоацил – тРНК», М.: «Наука», 1984
Спирин А.С., «Молекулярная биология: Структура рибосомы и биосинтеза белка». М.: Высш.шк., 1986.
Александр Батурин
Биоинформатика в мире РНК-структур
Понимание, как формируется пространственная конфигурация РНК, необходимо для разработки методов предсказания вторичных структур молекул и определения выполняемых ими функций в клетке живых организмов
рисунок А.В. Головина
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Амбициозный проект «Геном человека», завершившийся в 2003 году, был призван расшифровать всю ДНК, содержащуюся в человеческом геноме. Считалось, что проект поможет понять, как функционируют гены, каким образом они определяют состояние клетки и организма человека в целом, а также даст толчок развитию медицины и биологических наук. Однако исследования показали, что вся сложность клетки как целостной системы не сводится к одному лишь геному. Функционирование и роль молекулы РНК в регуляции клеточных процессов во многом зависят от ее пространственной организации, изучение которой — сложная задача, справиться с которой под силу только биоинформатике.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Биоинформатика и молекулярная эволюция».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Вторичная структура РНК
У прокариот процесс транскрипции и трансляции обычно сопряжен в пространстве и во времени. — Ред.
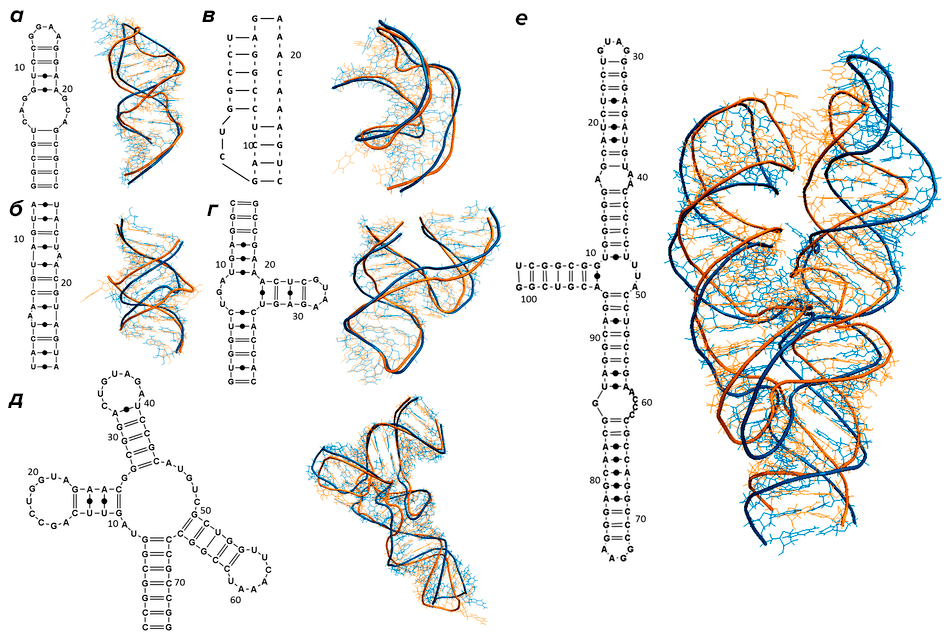
Дело в том, что РНК, подобно белковым молекулам [4], не существуют в виде простой цепочки. Нуклеотиды РНК взаимодействуют друг с другом, объединяясь в пары по принципу комплементарности, в результате чего молекула нуклеиновой кислоты приобретает причудливую конфигурацию: возникают петли, шпильки, псевдоузлы и другие формы (рис. 1). Если первичная структура — это просто последовательность нуклеотидов, то подобные образования относятся к вторичной структуре. И этот уровень организации молекулы также несет информацию, которая используется в регуляции таких процессов, как транскрипция ДНК, сплайсинг РНК, изменение активности генов с помощью микроРНК, а также транспорт транскриптов в определенные области клетки [5].
Рисунок 1. Разнообразие вторичных структур РНК: а — шпилька с внутренней петлей; б — дуплекс с двумя выступами; в — псевдоузел; г — молотовидный рибозим (hammerhead ribozyme) PDB: 1NYI; д — тРНК PDB: 1J1U; е — РНК из белок-РНКовго комплекса, узнающего и осуществляющего доставку на мембрану синтезируемых на рибосоме мембранных белков (SRP RNA) PDB: 1Z43. Справа от каждой структуры показана ее 3D-модель: предсказанные с помощью вычислительных методов (синий цвет) и полученные экспериментально (желтый цвет).
Вторичная структура также влияет на взаимодействие РНК с молекулами, например, со специфическими белками RBP (RNA binding proteins). Они связываются с РНК с образованием рибонуклеопротеиновых комплексов и регулируют сплайсинг, трансляцию и другие процессы. Если участок связывания «закрыт» петлей, белок не сможет провзаимодействовать с молекулой [6]. Роль вторичной структуры можно также проиллюстрировать воздействием мутаций. В работе Мэтью Халворсена (Matthew Halvorsen), опубликованной в журнале PLoS Genetics в 2010 году, изучались мутации, связанные с заболеваниями человека и находящиеся в регуляторных участках РНК, называемых 5′- и 3′-нетранслируемыми областями. Эти области отвечают за регуляцию процесса трансляции, деградацию РНК, участвуют в РНК-интерференции и при этом сильно структурированы. Мутации могут вызвать серьезные структурные перестройки, что становится причиной таких заболеваний, как наследственный синдром гиперферритинемии-катаракты, ретинобластома или гипертензия [7].
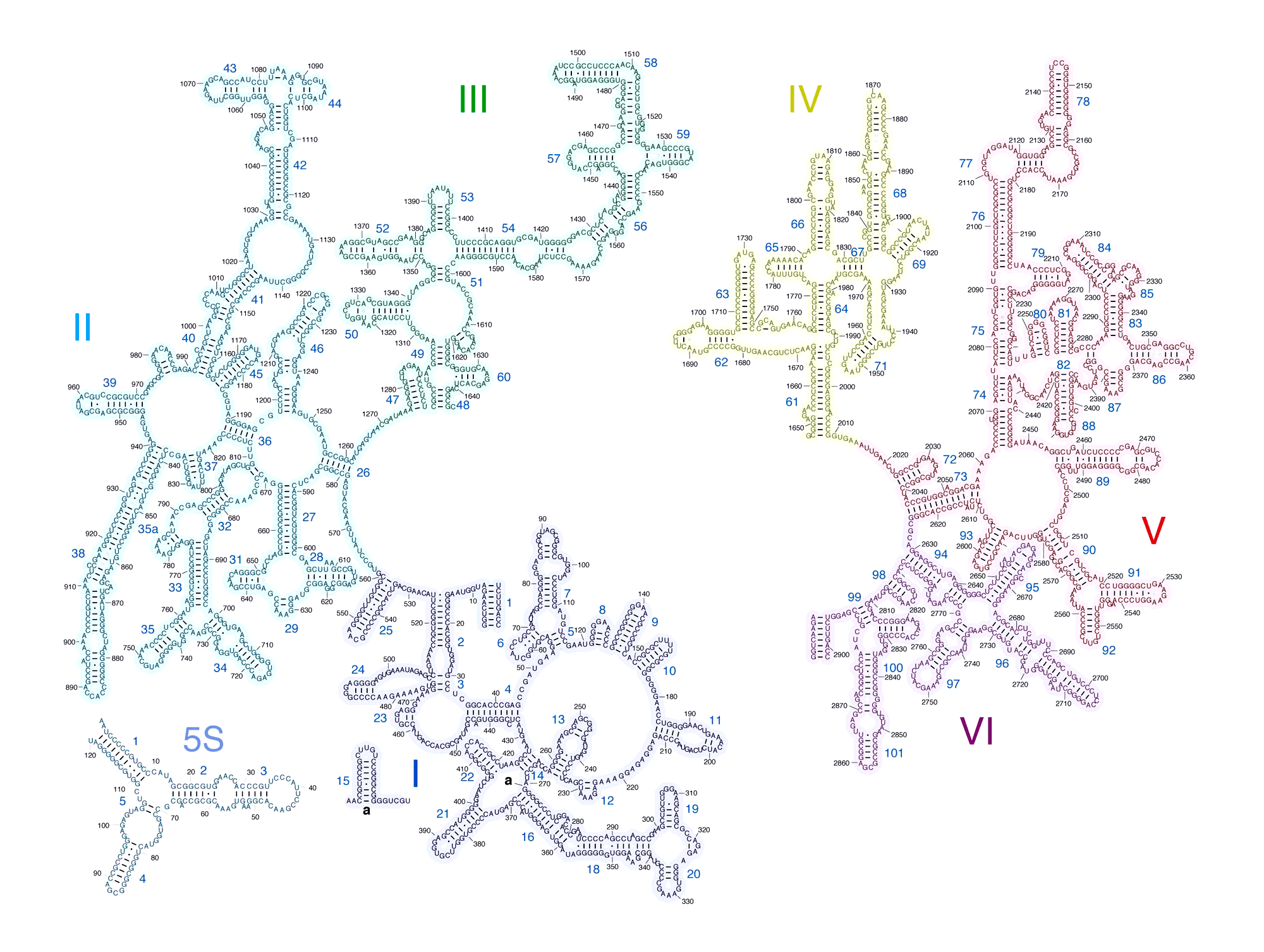
Рисунок 2. Вторичная структура РНК большой рибосомной субъединицы Escherichia coli
При наличии определенных факторов конфигурация РНК может изменяться, что, в свою очередь, влияет на регуляцию генов. Один из лучших примеров специфичности и динамичности вторичной структуры — РНК-переключатели (riboswitch), имеющиеся в клетках бактерий, дрожжей, водорослей и высших растений. Это участки мРНК, которые способны получать информацию о внутриклеточных условиях, связываясь с лигандами. Обычно РНК-переключатели состоят из двух доменов — аптамера, который взаимодействует с лигандами, и домена экспрессии. Как только лиганд (аминокислота, нуклеотиды, ионы металлов) связывается с аптамером, происходят изменения во вторичной структуре примыкающего к аптамеру домена экспрессии, что имеет значение для дальнейшей судьбы мРНК. Например, возникновение шпилек может воспрепятствовать транскрипции или синтезу белка в рибосомах [5]. Структура аптамера, подобно устройству дверного замка, подходит только определенному лиганду, который играет роль ключа
РНК-структуромика
Весь клеточный набор вторичных РНК-структур называется «РНК-струтурóмом» (по аналогии с генóмом или транскриптóмом) [2]. Исследование структурома позволяет ученым понять, как определенные разновидности (мотивы) укладки молекул РНК связаны с участием в различных клеточных процессах, таких как транскрипция, сплайсинг, локализация в клетке, трансляция и регуляция транскриптов. Здесь ученые сталкиваются с определенными проблемами. Недостаточно высокая эффективность методов изучения структуры РНК и сложность получения длинных фрагментов РНК — существенные препятствия на пути к полному описанию структурома. Однако буквально за последние годы технологии секвенирования совершили огромный скачок в развитии. Появились инструменты секвенирования нового поколения, которые позволяют с высокой точностью и относительно быстро определить последовательности ДНК и РНК. Очень важно также использование вычислительных методов, которые сильно продвинулись в своей способности точно предсказывать структуру РНК. При этом все же золотым стандартом определения структуры РНК был и остается эксперимент [5].
Исследования с использованием компьютерных методов привели ко многим открытиям. Например, транспортные РНК обладают структурными особенностями, которые соответствуют их функциям. Для поиска тРНК существуют различные инструменты, например, программа tRNAscan-SE, написанная на популярном среди биоинформатиков языке Perl. Она занимается поиском «подозрительных» участков в геноме, которые могут кодировать тРНК. После тщательного «просеивания» этих участков, остаются гены, которые являются истинными тРНК с вероятностью в 99–100%. Программа ориентируется не только на последовательность нуклеотидов, которая может различаться у разных тРНК, но также на вторичную структуру, являющейся общей для всех тРНК и напоминающей лист клевера. Кроме этого, tRNAscan-SE сравнивает гены-кандидатов с последовательностью, структура которой известна. Если гены-кандидаты формируют такую же структуру, значит они с высокой вероятностью являются тРНК [8].
Естественный отбор имеет значение
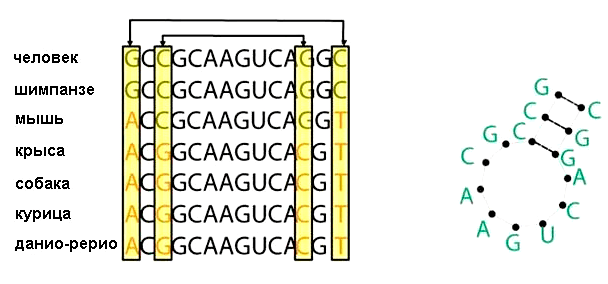
Как узнать, что на данной последовательности образуется структура? Для этого нужно, чтобы замена нуклеотида на одном участке последовательности обязательно сопровождалась компенсаторной заменой нуклеотида на другом участке последовательности [9]. Это значит, что оба нуклеотида участвуют в формировании структуры, к примеру, образуя пару G—C или A—U. Структура сохранится, если пара G—C заменится на пару A—U или наоборот. Когда в распоряжении есть достаточное количество гомологов, то, исходя из расположения многих консервативных пар, можно вывести вторичную структуру РНК (рис. 3).
Рисунок 3. Консервативность пар оснований в гомологичных последовательностях является основой для предсказания вторичной структуры. Стрелочками указаны взаимодействующие друг с другом нуклеотиды, которые могут быть различными в ряду последовательностей, однако сохраняющие конфигурацию молекулы (справа).
Вездесущая термодинамика
Когда в распоряжении исследователя имеется не ряд гомологов, а только одна последовательность, имеет смысл воспользоваться термодинамическим моделированием. Предполагается, что молекула РНК правильной структуры находится в состоянии термодинамического равновесия [10]. На основе энергетических параметров данной молекулы, полученных экспериментально, строятся всевозможные конфигурации вторичной структуры. Среди них ищут наиболее устойчивую, которая и будет правильным решением. Для коротких цепочек, длиной менее 700 пар оснований, данный метод корректно определяет структуру для 70% пар. Однако если цепочка длиннее, точность падает вплоть до 20%. Альтернативный подход — использование алгоритмов, основанных на вероятностном моделировании, — к сожалению, сильно уступает термодинамическим методам. Другая возможная стратегия — объединение термодинамического моделирования и машинного обучения [11]. Также с помощью PARS-метода можно выяснить, какие нуклеотиды являются непарными, чтобы исключить их из алгоритма и улучшить точность предсказания.
В методах предсказания вторичной структуры существуют существенные ограничения. Конформационные изменения РНК-переключателей в результате взаимодействия с лигандом настолько сложно смоделировать, что существующие алгоритмы оказываются бесполезными. Также большие трудности вызывает предсказание псевдоузлов, состоящих из двух совмещенных особым образом шпилек (рис. 1). Псевдоузлы встречаются в рРНК, тРНК, а также в геномах вирусных РНК, где они участвуют в процессах трансляции [12]. Для их поиска разрабатывают специальные методы, которые ориентированы на отдельные типы псевдоузлов. Однако с увеличением длины последовательности экспоненциально растет время, затрачиваемое алгоритмом на решение данной задачи. В этих условиях эксперимент становится необходим, позволяя ученым улучшить существующие алгоритмы и разработать новые стратегии поиска.
В игру вступает параллельное секвенирование
В параллельном анализе структуры РНК (или PARS-методе) применяются инструменты секвенирования нового поколения, которые позволяют получить миллионы расшифрованных последовательностей за один единственный эксперимент. Сначала образцам РНК позволяют свернуться с образованием вторичной структуры, затем их подвергают воздействию рибонуклеаз — ферментов, катализирующих расщепление связи между нуклеотидами. В PARS-методе используют два типа рибонуклеаз — V1 и S1. Первая расщепляет спаренные участки, вторая — простую цепь. Полученные фрагменты конвертируют в ДНК и секвенируют. Те фрагменты, которые были обработаны V1, в большинстве случаев обрываются на том нуклеотиде, который участвовал в образовании вторичной структуры. Сравнение большого числа копий одной РНК, позволяет судить об интенсивности расщепления на определенных участках молекулы и определить, формируется ли на этом участке вторичная структура [5].
С помощью PARS в 2010 году Кертес и его коллеги изучили вторичную структуру транскриптома дрожжей, проанализировав приблизительно 4,2 миллиона нуклеотидов в 3 тысячах транскриптов. Ими были обнаружены регуляторные мотивы, например, участок внутренней посадки рибосомы URE2, который позволяет начать синтез белка не с одного из концов мРНК, а с середины молекулы. Это исследование, опубликованное в журнале Nature [13], показало, что PARS-метод способен пролить свет на глобальную структурную организацию мРНК. Было открыто преимущественное расположение вторичных структур в кодирующих участках по сравнению с нетранслируемыми областями, а также их роль в регуляции процесса трансляции, который протекает тем активнее, чем менее структурирован сайт инициации трансляции. Объединение параллельного анализа с программными средствами предсказания конфигурации, а также термодинамическим моделированием, дает в руки ученых мощный инструмент для более глубокого постижения мира РНК-структур, что способствует появлению новых гипотез и открытий, касающихся регуляции клеточных процессов.
Стóит отметить, что данный метод дает весьма приблизительную и косвенную информацию о вторичной структуре РНК. На данный момент разработаны более «продвинутые» экспериментальные методики, основанные на химической модификации неспаренных нуклеотидов и позволяющие получать данные более высокого разрешения (напр. SHAPE). — Ред.
Самая большая РНК-лаборатория в мире
Моделирование вторичной структуры РНК, несмотря на большое количество методов, до сих пор остается сложной задачей. Не все принципы известны, а экспериментальные данные настолько обширны, что на анализ, который проводят небольшие группы ученых, уходит много труда и времени. Чтобы решить эту проблему, в университете Карнеги-Меллон и Стэнфордском университете разработали краудсорсинговый проект EteRNA.
В последние годы все больше серьезных научных проектов идут «в народ» в форме онлайн-игр. Такое явление получило название «гражданской науки». Примером аналогичной инициативы служит аркадная игра FoldIt, нацеленная на предсказание строения белковых молекул: «Тетрис XXI века» [14]. — Ред.
Концепция «мусорной ДНК» неоднократно сильно менялась: лет 10 назад бытовало мнение, что ДНК «активна лишь на 10%», а всё остальное является бесполезным кладбищем генов. В последнее время эти воззрения сильно модифицировались, в который раз подтверждая, что не все так просто: «Сколько сора в нашей ДНК» [16]. — Ред.
Транспортные РНК как молекулярные реликты
Относится к разделу Молекулярная биология
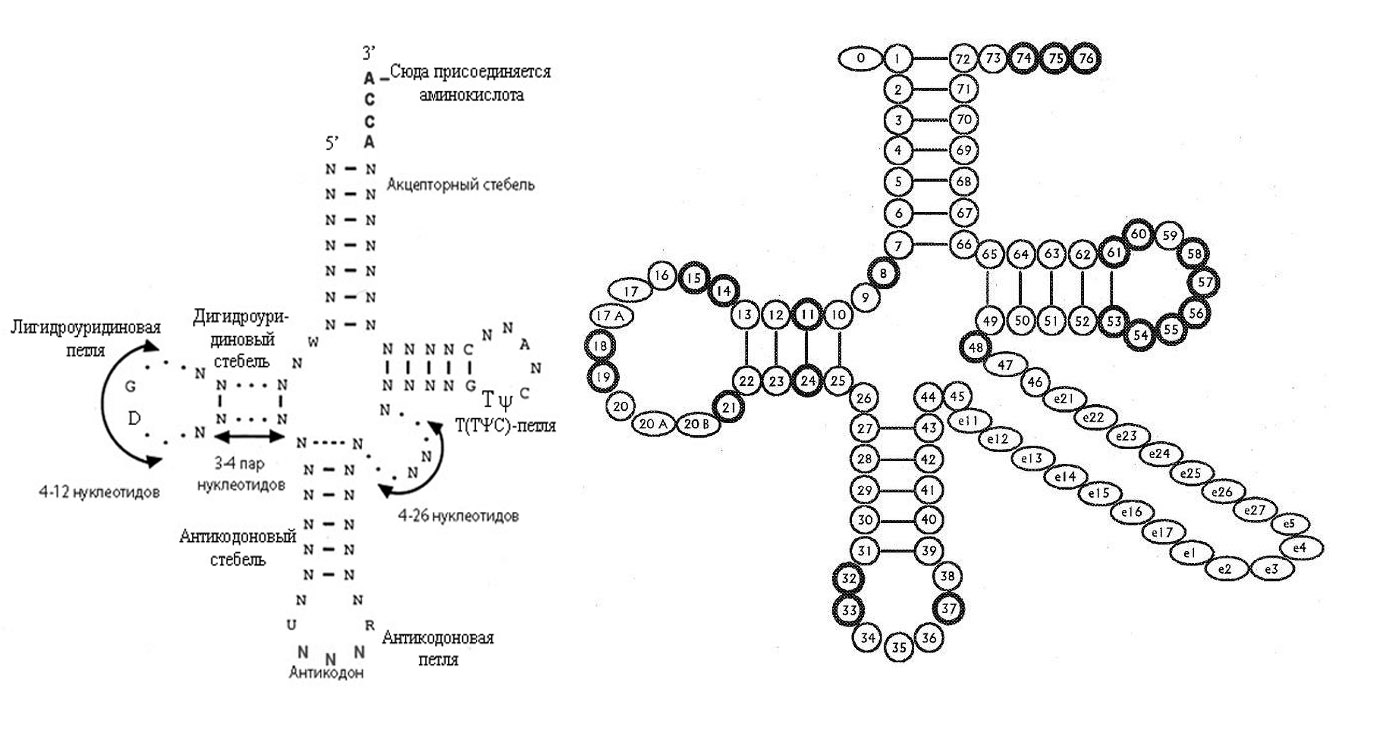
Среди модифицированных остатков часто встречаются псевдоуридин (5-рибофуранозилурацил, Ψ), 5,6- дигидроуридин ( D ), 4-тиоуридил и инозин. Структура некоторых модифицированный оснований и частично их роль изложены в статье Молекулярные механизмы обеспечения вырожденности кода
Наряду с первичной структурой (это просто последовательность нуклеотидов), молекула тРНК обладает вторичной и третичной структурой.
Вторичная структура обусловлена образованием водородных связей между нуклеотидами. Ещё в школе учат про водородные связи при комплементарным спариванием между нуклеотидами (A-U и G-C такой вид спаривания нуклеотидов называют каноническим), но в молекулах тРНК также образуется немалое количество неканонических связей, в частности, между G и U, которые будет несколько слабее и энергетически менее выгодная ).
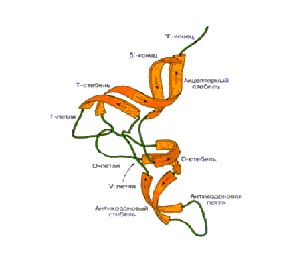
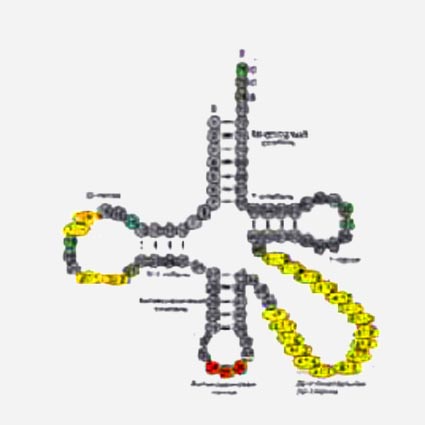
Рис. 1. Обобщённая вторичная структура тРНК (слева) и общепринятая нумерация нуклеотидов в тРНК (справа). Так она выглядит почти у всех живых организмов. На правом рисунке консервативные нуклеотиды выделены жирными кружочками.
Транспортные РНК во всех живых организмах последовательно выполняют три фукнции, необходимые для осуществления синтеза белка:
Вторичная структура трнк имеет форму
Строение и уровни организации РНК
Структура рибонуклеиновой кислоты
Первичная структура РНК
Таким образом, широко известные отличия состава РНК от ДНК имеют огромное биологическое значение: ведь свою функцию молекулы РНК способны выполнять только в одноцепочечном состоянии, что наиболее очевидно для мРНК: трудно представить, как бы могла двухцепочечная молекула транслироваться на рибосомах.
Вместе с тем, оставаясь одиночной, в некоторых участках цепь РНК может образовывать петли, выступы или «шпильки», с двухцепочечной структурой (рис.1.). Эта структура стабилизирована взаимодействием оснований в парах А::У и Г. Ц. Однако могут образовываться и «не правильные» пары (например, Г •••• У), а в некоторых местах «шпильки» и вообще не происходит никакого взаимодействия. В составе таких петель может содержаться (особенно в тРНК и рРНК) до 50 % всех нуклеотидов. Общее же содержание нуклеотидов в РНК варьирует от 75 единиц до многих тысяч. Но даже самые крупные РНК на несколько порядков короче хромосомных ДНК.
Первичная структура мРНК скопирована с участка ДНК, содержащего информацию о первичной структуре полипептидной цепи. Первичная структура остальных типов РНК (тРНК, рРНК, редкие РНК) является окончательной копией генетической программы соответствующих генов ДНК.
Вторичная и третичная структуры РНК
Рибонуклеиновые кислоты (РНК) — однонитевые молекулы, поэтому в отличие от ДНК их вторичная и третичная структуры нерегулярны. Эти структуры, определяемые как пространственная конформация полинуклеотидной цепи, формируются в основном за счет водородных связей и гидрофобных взаимодействий между азотистыми основаниями. Если для молекулы нативной ДНК характерна устойчивая спираль, то структура РНК более многообразна и лабильна. Рентгеноструктурный анализ показал, что отдельные участки полинуклеотидной цепи РНК, перегибаясь, навиваются сами на себя с образованием внутриспиральных структур. Стабилизация структур достигается за счет комплементарных спариваний азотистых оснований антипараллельных участков цепи; специфическими парами здесь являются А-U, G-С и, реже, G–U. Благодаря этому в молекуле РНК возникают как короткие, так и протяженные биспиральные участки, принадлежащие одной цепи; эти участки носят название шпилек. Модель вторичной структуры РНК со шпилькообразными элементами была создана в конце 50-х — начале 60-х гг. XX в. в лабораториях А. С. Спирина (Россия) и П. Доти (США).
Образование спиральных структур сопровождается гипохромным эффектом — уменьшением оптической плотности образцов РНК при 260 нм. Разрушение этих структур происходит при понижении ионной силы раствора РНК или при его нагревании до 60-70 °С; оно также называется плавлением и объясняется структурным переходом спираль — хаотический клубок, что сопровождается увеличением оптической плотности раствора нуклеиновой кислоты.
Информационная РНК образуется в результате процессинга (созревания) г-я-РНК, при котором происходят отсечение шпилек, вырезание некодирующих участков (интронов) и склеивание кодирующих экзонов.
Информационная РНК (и-РНК) представляет собой копию определенного участка ДНК и выполняет роль переносчика генетической информации от ДНК к месту синтеза белка (рибосомы) и непосредственно участвует в сборке его молекул.
Другое дело, что иногда пептидная цепь вскоре после образования на рибосоме разрезается на несколько более мелких цепей. Так бывает, например, при синтезе инсулина и целого ряда олигопептидных гормонов.
Кодирующая часть зрелой м-РНК эукариот лишена интронов — каких-либо вставочных некодирующих последовательностей. Иными словами, имеется непрерывная последовательность смысловых кодонов, которая должна читаться в направлении 5′ —>3′.
3′-нетранслируемый участок и поли(А)-фрагмент имеют отношение к регуляции продолжительности жизни м-РНК, поскольку разрушение м-РНК осуществляется 3′-экзонуклеазами. После окончания трансляции м-РНК от поли(А)-фрагмента отщепляются 10-15 нуклеотидов. Когда данный фрагмент исчерпывается, начинает разрушаться значащая часть мРНК (если отсутствует 3′-нетранслируемый участок).
Общее количество нуклеотидов в мРНК обычно варьирует в пределах нескольких тысяч. При этом на кодирующую часть иногда может приходиться лишь 60-70 % нуклеотидов.
В клетках молекулы мРНК практически всегда связаны с белками. Последние, вероятно, стабилизируют линейную структуру мРНК, т. е. предупреждают образование в кодирующей части «шпилек». Кроме того, белки могут защищать м-РНК от преждевременного разрушения. Такие комплексы мРНК с белками иногда называют информосомами.
Транспортная РНК
Транспортная РНК в цитоплазме клетки переносит аминокислоты в активированной форме к рибосомам, где они соединяются в пептидные цепи в определенной последовательности, которую задает РНК-матрица (мРНК). В настоящее время известны данные о нуклеотидной последовательности более чем 1700 видов тРНК из прокариотических и эукариотических организмов. Все они имеют общие черты как в их первичной структуре, так и в способе складывания полинуклеотидной цепи во вторичную структуру за счет комплементарного взаимодействия входящих в их структуру нуклеотидов.
Транспортная РНК в своем составе содержит не больше 100 нуклеотидов, среди которых отмечается высокое содержание минорных, или модифицированных, нуклеотидов.
Аланиновая тРНК содержит 9 необычных оснований с одной или несколькими метильными группами, которые присоединяются к ним ферментативным путем уже после образования фосфодиэфирных связей между нуклеотидами. Эти основания неспособны к образованию обычных пар; возможно, они служат для того, чтобы препятствовать спариванию оснований в определенных частях молекулы и таким образом обнажать специфические химические группы, которые образуют вторичные связи с информационной РНК, рибосомой или, быть может, с ферментом, необходимым для присоединения определенной аминокислоты к соответствующей транспортной РНК.
Известная последовательность нуклеотидов в тРНК по существу означает, что известна также его последовательность в генах, на которых эта тРНК синтезируется. Эту последовательность можно вывести основываясь на правилах специфического спаривания оснований, установленных Уотсоном и Криком. В 1970 году была синтезирована полная двухцепочечная молекула ДНК с соответсвующей последовательностью из 77 нуклеотидов, и оказалось, что она может служить матрицей для построения аланиновой транспортной РНК. Это был первый искусственно синтезированный ген.
Вторым этапом вновь синтезированная предшественница тРНК проходит послетранскрипционное созревание или процессинг. В ходе процессинга удаляются неинформативные излишки в пре-РНК и образуются зрелые, функциональные молекулы РНК.
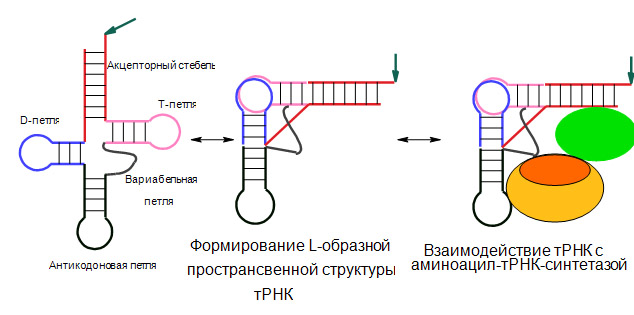
По завершении процессинга во вторичной структуре вновь образуются дополнительные водородные связи за счет которых тРНК переходит на третичный уровень организации и принимает вид так называемой L-формы. В таком виде тРНК уходит в гиалоплазму.
В основе структуры транспортной РНК лежит цепочка нуклеотидов. Однако в силу того, что любая цепочка нуклеотидов имеет положительно и отрицательно заряженные части, она не может находиться в клетке в развернутом состоянии. Эти заряженные части притягиваясь друг к другу легко образуют между собой водородные связи по принципу комплементарности. Водородные связи причудливо скручивают нить т-РНК и удерживают ее в таком положении. В результате этого вторичная структура т-РНК имеет вид «клеверного листа» (рис. ), содержащего в своей структуре 4 двухцепочечных участка. Высокое содержание минорных или модифицированных нуклеотидов, отмечаемых в цепи тРНК и неспособных к комплементарным взаимодействиям, формирует 5 одноцепочечных участков.
Третичная структура т-РНК уже не имеет формы клеверного листа. За счет образования водородных связей между нуклеотидами из разных частей «листа клевера» его лепестки заворачиваются на тело молекулы и удерживаются в таком положении дополнительно ван-дер-ваальсовыми связями, напоминая собой форму буквы Г или L. Наличие стабильной третичной структуры является еще одной особенностью т-РНК, в отличие от длинных линейных полинуклеотидов м-РНК. Понять, как именно изгибаются различные части вторичной структуры т-РНК при образовании третичной структуры можно по рис., сопоставив цвета схемы вторичной и третичной структуры т-РНК.
В процессе синтеза белка т-РНК антикодоном распознает трехбуквенную последовательность генетического кода (кодона) и-РНК, сопоставляя ей единственную соответствующую аминокислоту, закрепленную на другом конце тРНК. Только в случае комплементарности антикодона к участку мРНК транспортная РНК может к ней присоединиться и отдать переносимую аминокислоту на формирование протеиновой цепочки. Взаимодействие т-РНК и и-РНК происходит в рибосоме, которая также является активным участником трансляции.
АРСазы обладают способностью выборочно использовать при узнавании ассортимент тРНК для каждой аминокислоты, т.е. ведущим звеном узнавания является аминокислота, а к ней подгоняется своя тРНК. Далее тРНК путем простой диффузии переносит присоединенную к ней аминокислоту к рибосомам, где происходит сборка белка из аминокислот, поступающих в виде разных аминоацил-тРНК.
Связывание аминокислоты с тРНК
Аминоацилирование происходит в процессе замены присоединенной к аминокислоте молекулы АМФ на молекулу тРНК. После этой замены АМФ покидает синтетазу, а тРНК задерживается для последней проверки аминокислоты.
Проверка соответствия тРНК присоединенной аминокислоте
Модель синтетазы для проверки соответствия тРНК присоединенной аминокислоте предполагает наличие двух активных центров: синтетического и коррекционного. В синтетическом центре происходит присоединение тРНК к аминокислоте. Акцепторный участок тРНК, захваченной синтетазой, вначале контактирует с синтетическим центром, в котором уже размещена аминокислота, соединенная с АМФ. Этот контакт акцепторного участка тРНК придает ему неестественный изгиб до момента присоединения аминокислоты. После того, как происходит присоединение аминокислоты с акцепторному участку тРНК, необходимость нахождения данного участка в синтетическом центре отпадает, тРНК распрямляется и перемещает присоединенную к ней аминокислоту в коррекционный центр. При несовпадении размеров молекулы аминокислоты, присоединенной к тРНК, и размеров коррекционного центра, аминокислота опознается как неправильная и отсоединяется от тРНК. Синтетаза готова к следующему циклу. При совпадении размеров молекулы аминокислоты, присоединенной к тРНК, и размеров коррекционного центра, заряженная аминокислотой тРНК освобождается: она готова сыграть свою роль в трансляции протеина. А синтетаза готова присоединить новые аминокислоту и тРНК, и начать повторный цикл.
Соединение несоответствующей аминокислоты с синтетазой в среднем происходит в 1-м случае из 50 тыс., а с ошибочной тРНК всего лишь один раз на 100 тысяч присоединений.
Взаимодействие тРНК с кодоном мРНК по принципу комплементраности и антипараллельности означает: поскольку смысл кодона мРНК читается в направлении 5’—>3′, то антикодон в тРНК должен читаться в направлении 3’—>5′. При этом первые два основания кодона и антикодона спариваются строго комплементарно, т. е. образуются только пары А У и Г Ц. Спаривание же третьих оснований может отступать от этого принципа. Допустимые пары определяются схемой:
| Третий нуклеотид антикодона тРНК: | Ц | А | У | Г | И | ||||
| Взаимодействующие с ним нуклеотиды кодонов мРНК | Г | У | A | Г | У | Ц | У | Ц | А |
Отсюда, в свою очередь, следует, что для узнавания 61 смыслового кодона требуется, в принципе, не такое же, а меньшее количество разных тРНК.
Рибосомальная РНК
Рибосомальные РНК являются основой для формирования субъединиц рибосом. Рибосомы обеспечивают пространственное взаиморасположение мРНК и тРНК в процессе синтеза белка.
Каждая рибосома состоит из большой и малой субъединиц. Субъединицы включают в себя большое количество белков и рибосомальные РНК, которые не подвергаются трансляции. Рибосомы, как и рибосомальные РНК, различаются по коэффициенту седиментации (осаждения), измеряемому в единицах Сведберга (S). Данный коэффициент зависит от скорости осаждения субъединиц при центрифугировании в насыщенной водной среде.
Субъединицы образуют «скелет» рибосомы, каждый из которых окружен своими белками. Коэффициент седиментации полной рибосомы не совпадает с суммой коэффициентов двух ее субъединиц, что связано с пространственной конфигурацией молекулы.
В рРНК среди азотистых оснований выше чем обычно содержание гуанина и цитозина. Встречаются также минорные нуклеозиды, но не столь часто, как в тРНК: примерно 1 %. Это, в основном, нуклеозиды, метилированные по рибозе. Во вторичной структуре рРНК много двухцепочечных участков и петель (рис.). Таково строение молекул РНК, образуемых в двух последовательно проходящих процессах — транскрипции ДНК и созревании (процессинге) РНК.
Транскрипция рРНК с ДНК и процессинг рРНК
Пре-рРНК образуется в ядрышке, где находятся транскриптоны рРНК. Траснкрипция рРНК с ДНК происходит при помощи двух дополнительных РНК-полимераз. РНК-полимераза I транскрибирует 5S, 5,8S и 28S в виде одного длинного 45S-тpaнскрипта, который затем разделяется на необходимые части. Таким образом обеспечивается равное количество молекул. В организме человека в каждом гаплоидном геноме присутствует примерно 250 копий последовательности ДНК, кодирующей 45S-транскрипт. Они расположены в пяти кластерных тандемных повторах (т. е. попарно друг за другом) в коротких плечах хромосом 13, 14, 15, 21 и 22. Данные участки известны как ядрышковые организаторы, так как их транскрипция и последующий процессинг 45S-транскрипта происходят внутри ядрышка.
Не менее чем в трёх кластерах хромосомы 1 существует 2000 копий 5S-pPHK гена. Их транскрипция протекает в присутствии РНК-полимеразы III снаружи ядрышка.
В ходе процессинга остается чуть больше половины пре-рРНК и освобождаются зрелые рРНК. Часть нуклеотидов рРНК подвергается модификации, которая состоит в метилировании оснований. Реакция осуществляется метилтрансферазами. В роли донора метальных групп выступает S-аденозилметионин. Зрелые рРНК соединяются в ядре с белками рибосом, поступающих сюда из цитоплазмы, и образуют малую и большую субчастицы рибосом. Зрелые рРНК транспортируются из ядра в цитоплазму в комплексе с белком, который дополнительно защищает их от разрушения и способствует переносу.
Иногда говорят также о Е-центре (от «exit» — выход), куда перемещается тРНК, потерявшая связь с пептидилом, перед тем, как покинуть рибосому. Однако можно рассматривать этот центр как составную часть П-центра.
Распределение центров между субъединицами
Инициация рибосомы (подготовка рибосомы к синтезу белка)
Синтез белка, или собственно трансляцию, принято разделять на три фазы: инициации (начало), элонгации (удлинение полипептидной цепи) и терминации (окончание). В фазу инициации происходит подготовка рибосомы к работе: соединение ее субъединиц. У бактериальных и эукариотических рибосом соединение субъединиц и начало трансляции протекает по-разному.
Малая субъединица соединяясь с мРНК представляет для считывания два кодона. На первом из них протеин IF-2 закрепляет инициаторную аа-тРНК. Второй кодон закрывает протеин IF-1, который блокирует его и не позволяет присоединиться следующей тРНК до момента полной сборки рибосомы.
Таким образом, формируется своеобразный «бутерброд» из четырех основных компонентов. При этом в П-центре собранной рибосомы оказываются инициирующий кодон мРНК (АУГ) и связанная с ним инициирующая аа-тРНК. Последняя при образовании первой пептидной связи играет роль пептидил-тРНК.
Превращение гяРНК в иРНК путём удаления интронов проходит в ядерном комплексе РНК-белков, называемом сплайсомой. У каждой сплайсомы есть ядро, состоящее из трёх малых (низкомолекулярных) ядерных рибонуклеопротеинов, или снурпов. Каждый снурп содержит хотя бы одну малую ядерную РНК и несколько белков. Существует несколько сотен различных малых ядерных РНК, транскрибируемых в основном РНК-полимеразой II. Считают, что их основная функция — распознавание специфических рибонуклеиновых последовательностей посредством спаривания оснований по типу РНК—РНК. Для процессинга гяРНК наиболее важны Ul, U2, U4/U6 и U5.
Митохондриальная РНК
Митохондриальная ДНК представляет собой непрерывную петлю и кодирует 13 полипептидов, 22 тРНК и 2 рРНК (16S и 23S). Большинство генов находятся на одной (тяжёлой) цепи, однако некоторое их количество расположено и на комплементарной ей лёгкой. При этом обе цепи транскрибируются в виде непрерывных транскриптов при помощи митохондриоспецифической РНК-полимеразы. Данный фермент кодируется ядерным геном. Длинные молекулы РНК затем расщепляются на 37 отдельных видов, а мРНК, рРНК и тРНК совместно транслируют 13 мРНК. Большое количество дополнительных белков, которые поступают в митохондрию из цитоплазмы, транслируются с ядерных генов. У пациентов с системной красной волчанкой обнаруживают антитела к снурп-белкам собственного организма. Кроме того, считают, что определённый набор генов малой ядерной РНК хромосомы 15q играет важную роль в патогенезе синдрома Прадера—Вилли (наследственное сочетание олигофрении, низкого роста, ожирения, гипотонии мышц).